
【题目】水杨酸是合成阿斯匹林的重要原料.水杨酸的学名邻羟基苯甲酸,结构简式为![]() ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团__.
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于醛类化合物的结构简式(写一种即可):__.
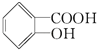
(3)水杨酸的另一种同分异构体的结构简式为![]() ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
A.1mol B.2mol C.3mol D.4mol.
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: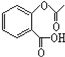 ,则阿斯匹林的分子式为__.
,则阿斯匹林的分子式为__.
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)__.
【答案】羧基和酚羟基 ![]() C C9H8O4 氯化铁溶液
C C9H8O4 氯化铁溶液
【解析】
 含有羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和显色反应,结合官能团的性质以及题目要求解答该题。
含有羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和显色反应,结合官能团的性质以及题目要求解答该题。
(1)水杨酸中含有官能团名称是羧基和酚羟基,故答案为:羧基和酚羟基;
(2)水杨酸![]() 的同分异构体符合含酚羟基,且含有醛基的所有同分异构体可为
的同分异构体符合含酚羟基,且含有醛基的所有同分异构体可为![]() 等,也可含有1个醛基、2个羟基,故答案为:
等,也可含有1个醛基、2个羟基,故答案为:![]() 等;
等;
(3)能和氢氧化钠反应的有酚羟基和酯基水解生成的酚羟基和羧基,所以1mol该有机物![]() 在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为3mol,故选C;
在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为3mol,故选C;
(4)有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: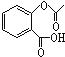 ,则阿斯匹林的分子式为C9H8O4,故答案为:C9H8O4;
,则阿斯匹林的分子式为C9H8O4,故答案为:C9H8O4;
(5)、阿司匹林变质时发生水解反应生成酚羟基,所以可以用氯化铁溶液检验,故答案为:氯化铁溶液。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)某气态有机物相对于氢气的密度为14,则其结构简式为____________。
(2)某有机物的结构简式如图所示,则其一氯代物共有_______种。
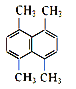
(3)新戊烷用系统命名法命名应为_______。
(4)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是______(填分子式)。
(5)下列最简式中,只能代表一种有机物的有________(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若1mol NF3被氧化,反应转移电子数为2NA
C. 若生成0.4molHNO3,则转移0.4mol电子
D. 氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
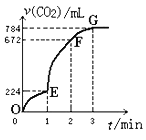
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com