
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
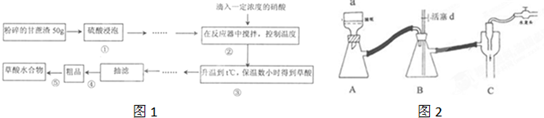
分析 Ⅰ、(1)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;抽滤完毕或中途停止抽滤时,为保持内外压强的平衡,应先断开连接安全瓶与抽气装置间的橡皮管,该装置只需慢慢打开活塞d,然后关闭抽气装置中的水龙头;
Ⅱ、(1)配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、量筒、100mL容量瓶、胶头滴管、玻璃棒等;
(2)酸性条件下,高锰酸钾具有强氧化性,能氧化还原性物质,草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4),计算草酸的质量,根据化学式质量分数计算求X的值;
【实验内容】:(1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢;
(2)根据对比实验中不同物理量确定褪色时间长短,从而确定反应速率的影响因素;
解答 解:Ⅰ、(1)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;抽滤完毕停止抽滤时,为防止倒吸,为保持内外压强的平衡,先慢慢打开活塞d,然后关闭水龙头,
故答案为:加快过滤速度、得到较干燥的沉淀;慢慢打开活塞d,然后关闭水龙头;
Ⅱ、(1)配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)称固体、烧杯溶解固体、100mL容量瓶配制溶液、胶头滴管定容、玻璃棒搅拌引流等,所以缺少玻璃仪器为100mL容量瓶,
故答案为:100mL容量瓶;
(2)草酸溶液与酸性高锰酸钾溶液发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,
n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,
根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,
则100mL草酸溶液中n′(H2C2O4)=2.5×c×(b-a)×10-3mol×$\frac{100mL}{25mL}$=c×(b-a)×10-2mol,
草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,
由化学式可知:$\frac{90}{90+18x}$=$\frac{c×(b-a)×1{0}^{-2}mol×90g/mol}{Wg}$,解得x=$\frac{50W}{9c(b-a)}$-5,
故答案为:$\frac{50W}{9c(b-a)}$-5;
【实验内容】:(1)根据表中数据知,有硫酸锰的溶液褪色时间短,反应速率快,没有硫酸锰的溶液褪色时间长、反应速率慢,说明硫酸锰作催化剂而加快反应速率,所以可假设:反应产物中的Mn2+可能是反应的催化剂,
故答案为:反应产物中的Mn2+可能是反应的催化剂;Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率[或需要Mn2+(硫酸锰)作催化剂],假设1成立;
(2)根据实验(2)、(3)表2和表3的实验结果可知:温度不同其褪色时间不同,说明温度对该反应速率有影响,根据实验(3)知,混合溶液中硫酸浓度不同其褪色时间不同,说明硫酸对草酸和KMnO4溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,褪色时间变短,而加入大量硫酸,反应速率比较小,褪色时间加长,说明温度对该反应速率影响不大,
故答案为:由表2和表3的实验结果可知:硫酸对草酸和高锰酸钾溶液的反应有影响,加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,草酸和高锰酸钾溶液的反应速率开始比较慢,随着反应的进行,褪色速率加快,温度对该反应速率影响不大.
点评 本题考查了物质的分离和提纯、化学平衡移动等知识点,为高频考点,侧重于学生的分析、实验计算能量的考查,题目综合性较强,掌握减压过滤操作、有关滴定的计算是解答本题的关键,本题难度较大.


科目:高中化学 来源: 题型:选择题
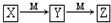 所示转化的是( )
所示转化的是( )| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气光照下反应的生成的氯代物都是气体 | |
| B. | 正丁烷的四个碳原子在同一条直线上 | |
| C. | 正丁烷的熔点、沸点都比异丁烷小 | |
| D. | 分子式为CnH2n+2分子中共用电子对数为3n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定前平视滴定管刻度线,滴定终了俯视刻度线 | |
| D. | 滴定前酸式滴定管尖嘴部分有气泡,滴定终了无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是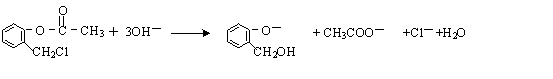 (写离子方程式).
(写离子方程式).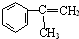 )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物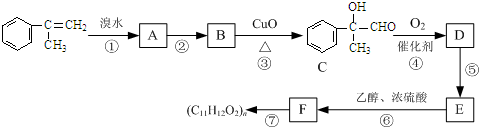
 、
、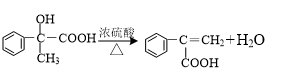 、
、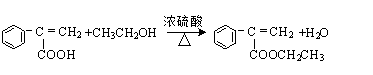 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com