
| 3.2g |
| 16g/mol |
| 2.24L |
| 22.4L/mol |
| 3.2g |
| 16g/mol |


科目:高中化学 来源: 题型:
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
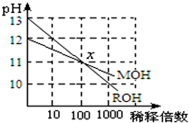 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是| A、稀释前,c(ROH)=10c(MOH) |
| B、在x点,c(M+)=c(R+) |
| C、在x点,ROH完全电离 |
| D、MOH是一种弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
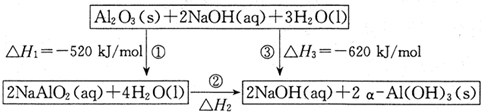
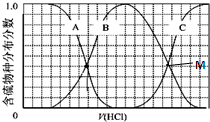
查看答案和解析>>
科目:高中化学 来源: 题型:
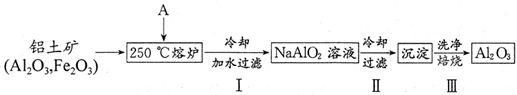
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | KClO3 | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 6 7.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
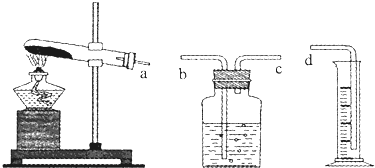
查看答案和解析>>
科目:高中化学 来源: 题型:
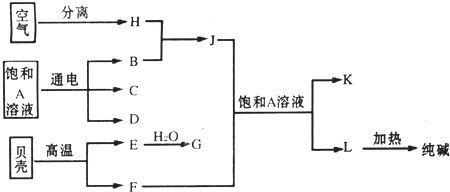

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com