
| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
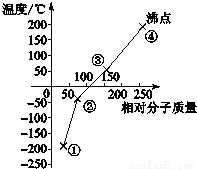
分析 卤素单质都属于分子晶体,其单质的沸点与其相对分子质量成正比,根据图象知,①②③④分别是F2、Cl2、Br2、I2,
A.卤族元素中,非金属的非金属性随着原子序数增大而减弱,非金属性越强,其单质越活泼;
B.次氯酸具有漂白性;
C.溴易挥发,在水中的溶解度较小,且密度大于水;
D.氟化氢分子间存在氢键.
解答 解:卤素单质都属于分子晶体,其单质的沸点与其相对分子质量成正比,根据图象知,①②③④分别是F2、Cl2、Br2、I2,
A.卤族元素中,非金属的非金属性随着原子序数增大而减弱,非金属性越强,其单质越活泼,所以单质活泼性最强的是F2,故A正确;
B.氯气和水反应生成次氯酸,次氯酸具有漂白性,所以单质②能使品红溶液褪色,故B正确;
C.溴易挥发,在水中的溶解度较小,且密度大于水,所以为防止溴挥发,可以用水液封,则单质③保存时加少量水进行水封,故C正确;
D.氟化氢分子间存在氢键,所以单质①的氢化物在卤素氢化物中沸点最高,故D错误;
故选D.
点评 以卤族元素代表非金属、碱金属元素代表金属熟记同一主族元素性质递变规律,并灵活运用,注意B中体现漂白性的不是氯气而使次氯酸,注意溴的贮存方法,为易错点.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com