
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热. | / |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中. | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮. |
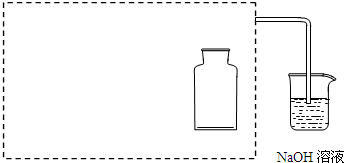
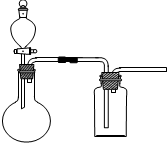 ,
, ;
;
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②④ | B、①②③ |
| C、①③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0的反应使体系能量升高,不能自发进行 |
| B、△H<0的反应使体系能量降低,无需加热便能自发进行 |
| C、在与外界隔离的体系中,自发过程将导致熵增大 |
| D、熵增原理说明△S<0过程在任何条件下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2200℃~2300℃ |
| HgCl2 |
| 140℃~200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 表示的分子式
表示的分子式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com