
| A. | H+、OH-、NO3- | B. | Ba2+、H+、SO42- | C. | K+、OH-、CO32- | D. | Fe3+、Cl-、OH- |
科目:高中化学 来源: 题型:解答题
 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
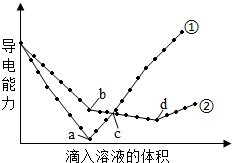 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | ①代表滴加H2SO4溶液的变化曲线 | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | c点,两溶液中含有相同量的OH- | |
| D. | a、d两点对应的溶液均显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 对于任何化学反应,增大压强均可使单位体积内活化分子数增多,反应速率加快 | |
| C. | 加入反应物,可增加活化分子百分数,从而增大化学反应速率 | |
| D. | 某反应的△H=100kJ•mol-1,说明正反应活化能比逆反应活化能大100kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | n:(n+1) | C. | 1:(n+1) | D. | (n+1):n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

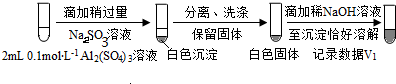
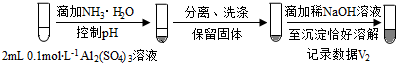 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 储热材料是一类重要的存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量 | |
| B. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| C. | Ba2+浓度较高时危害健康,但BaSO4可服入体内,作为造影剂用于X-射线检查肠胃道疾病 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+,Cu2+,Cd2+,Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打溶液与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| B. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-═NH3•H2O+BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com