
科目:高中化学 来源: 题型:选择题
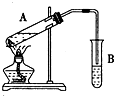
| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
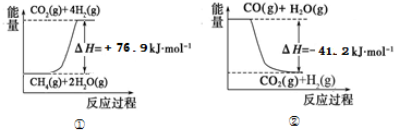
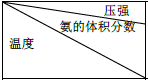 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
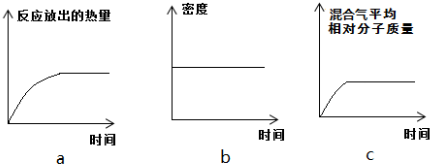
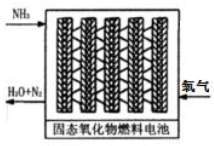
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3
③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
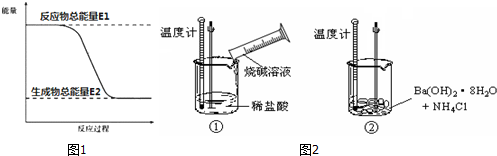
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com