
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 molL-1、0.0010 molL-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 molL-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/molL-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
【答案】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分)
(2)298;00.010温度(各1分,共4分)
(3)MnSO4(1分)如果选择MnCl2,则酸性高锰酸钾会和Cl-反应,而且引入Cl-无法证明是Mn2+起了催化作用(2分)(4)①1×10-4mol·L-1·min-1(2分)②否(1分)③取过量的相同体积、浓度不同的草酸溶液,分别与体积相同、浓度相同的酸性高锰酸钾溶液反应(2分)
【解析】
试题分析:(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2;
(2)实验①和③中温度不同,探究的是温度对反应速率的影响;实验①和④探究催化剂对反应速率的影响,所以实验④中除了催化剂以外其余均相同。
(3)由于如果选择MnCl2,则酸性高锰酸钾会和Cl-反应,而且引入Cl-无法证明是Mn2+起了催化作用,因此需要选择硫酸锰。
(4)①实验②中褪色需要时间的平均值为5min,则用KMnO4的浓度变化来表示的平均反应速率为![]() =1×10-4 mol·L-1·min-1;
=1×10-4 mol·L-1·min-1;
②从表中数据可知,相同体积的0.01mol/LKMnO4酸性溶液是0.001mol/LKMnO4酸性溶液10倍,但反应的时间却比其反应时间的二倍左右,由反应速率计算公式(v=△c/△t)可得出,此实验条件下KMnO4酸性溶液的浓度越大反应速率越快,因此结论错误;
③因根据直接看表中的褪色时间长短来判断浓度大小与反应速率的关系,需满足高锰酸钾的物质的量相同,浓度不同的草酸溶液,所以实验方案为取过量的相同体积、浓度不同的草酸溶液,分别与体积相同、浓度相同的酸性高锰酸钾溶液反应。


科目:高中化学 来源: 题型:
【题目】以下关于组成细胞的元素组成叙述正确的是( )
A. C元素因其在细胞的干重中含量最高,所以C是生命的最基本元素
B. C原子构成的碳链是蛋白质的骨架
C. 蛋白质和核酸中共有的元素是C、H、O
D. 构成细胞的微量元素就是指细胞中含量很少且可有可无的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mLNa2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再加过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:
(1)原混合液Na2SO4的物质的量浓度?
(2)产生的气体在标准状况下的体积为?
(3)过滤出沉淀后,所得滤液的物质的量浓度(反应前后体积变化忽略不计)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 二氧化硫可以使溴水褪色是因为它有漂白性
B. 浓硫酸可用于干燥H2S和CO2
C. 可以用加热法除去NaCl固体中的混有的NH4Cl
D. 过量的Cu与浓硝酸反应不可能有一氧化氮生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L稀氨水加水稀释,下列说法正确的是( )
A. 溶液中c(H+)和c(OH-)都减小 B. 溶液中c(H+)增大
C. NH3·H2O电离平衡向左移动 D. 溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据国外资料报道,在独居石 (一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)中,查明有尚未命名的116、124、126号元素.判断其中116号应位于周期表中的
A. 第六周期ⅣA族 B. 第七周期ⅥA族
C. 第七周期Ⅷ族 D. 第八周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )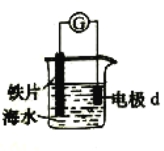
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]N、P、As都是同主族的元素。
(1)As基态原子的电子排布式为 。和砷位于同一周期,且未成对电子数也相同的元素还有 种。
(2)元素周期表中,与P紧邻的4种元素中电负性最强的是 (填元素符号),Si、P、S三元素第一电离能由大到小的顺序为 。
(3)NH3、PH3、AsH3三者的空间构型相同,都是 ,它们的沸点由高到低的顺序为 (填化学式)
(4)白磷是由P4分子形成的分子晶体,每个P4分子是正四面体结构(如图)。
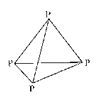
P的杂化方式为 。白磷易溶于CS2,难溶于水,原因是 。
(5)采用GaxIn(1-x)As(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn(1-x)As立方体形晶胞中每1个顶点和面心都有1个原子,晶胞内部有4个原子,则该晶胞中含有 个砷原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与热量变化有关,其中叙述正确的是
A.Ba(OH)2·8H2O与NH4Cl常温下混合就能反应,故该反应放热
B.已知2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol–1,故H2的燃烧热为241.8kJ·mol–1
C.已知H+-(aq)+OH-(aq)==H2O-(l)ΔH=-57.31kJ·mol–1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s)ΔH<-57.31kJ·mol–1
D.由图可知,反应C(金刚石,s)=C(石墨,s)的焓变ΔH=ΔH1-ΔH2
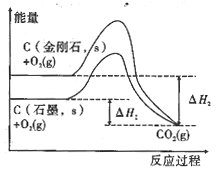
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com