
【题目】25℃时,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的绝热容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的体积 V与所得混合溶液温度 T的关系如图所示。 下列说法错误的是

A.25℃时 pH=2 的 HA 溶液中 HA 的电离度约为 10%
B.M 点溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 点溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的过程中水的电离程度先增大后减小,M 点水电离程度小于 P 点
【答案】B
【解析】
A. 酸碱中和反应是放热反应,故N点为酸碱恰好完全反应的点,则c(HA)=0.1 molL1,由HA溶液的pH=2可知,HA为弱酸且HA的电离度约![]() ,故A正确;
,故A正确;
B. M点V(HA)=10mL,NaOH被中和了一半,混合溶液中存在c(NaOH)= c(NaA),由于A-水解导致c(OH-)> c(A-),故B错误;
C. P点溶液中溶质为NaA和HA,浓度之比为2:1,根据物料守恒可知P点溶液中存在:3 c(Na+ )=2c(HA)+ 2c(A-),故C正确;
D. N点溶质为NaA,此时水的电离程度最大,故M→N→P的过程中水的电离程度先增大后减小,M点溶液中NaOH和P点HA的物质的量相等,但由于P点的溶液体积更大且HA为弱酸,故P点水的电离程度大于M点,故D正确。
综上所述,答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图均是由4个碳原子结合成的五种有机物(氢原子没有画出) 回答下列问题:

(1)空间结构为正四面体的化学式为___________________。
(2)五种物质中属于烯烃的是 ________(填字母,下同)。
(3)与e互为同分异构体的是_____________________。
(4)五种物质中4个碳原子一定处于同一平面的有_______________。
(5)写出b的一种同分异构体的结构简式:_____________________(C除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A. 与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B. 与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C. 深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)Ca(HCO3)2(aq)
D. 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
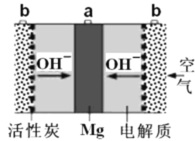
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.负极反应式为:Mg-2e-+2OH- = Mg(OH)2
C.活性炭可以加快O2在负极上的反应速率
D.电子的移动方向由a经外电路到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池因具有高的安全性和低廉的价格而备受关注,我国科学 家最近研发出一种新型镁电池,其工作原理如图所示。下列说法正确的是

A.I 室中的电解质溶液可以是稀 H2SO4
B.外电路中转移 2mol 电子时,N 极质量增加 24a g
C.离子交换膜为阳离子交换膜
D.电子流向:M 电极→I 室→离子交换膜→II 室→N 极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法正确的是( )
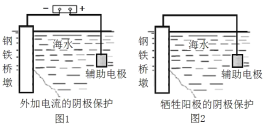
A.图1辅助电极的材料应为铜
B.图1通入的保护电流只与钢铁桥墩和辅助阳极的材料有关
C.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
D.钢铁桥墩在河水的腐蚀比海水中更快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙酮是重要的化工原料,某实验小组利用如图装置制备对甲基苯乙酮。

制备原理: (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表:
试剂名称 | 分子式 | 分子量 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 |
甲苯 | C7H8 | 92 | -93 | 110.6 | 0.8669 |
乙酸酐 | (CH3CO)2 | 102 | -73.1 | 138.6 | 1.08 |
对甲基苯乙酮 | C9H10O | 134 | 28 | 94(0.93kPa) | 1.0051 |
实验步骤:
步骤 1:如图所示,在 100mL 三颈烧瓶上安装搅拌器、仪器 x 和上口装有无水氯化钙的冷凝管,干燥管与一气体 吸收装置相连。
步骤 2:三颈烧瓶中快速加入研碎的催化剂和 20mL 无水甲苯,在搅拌的条件下通过仪器 x 缓慢地滴加 3.4mL 醋酸酐与 5mL 甲苯的混合液,约需 15min 滴完。
步骤 3:反应结束后,将三颈烧瓶在 95℃时加热 25~30min。
步骤 4:反应混合液冷却后转移到盛有 30mL 浓盐酸与 30mL 冰水的烧杯中(目的是将对甲基苯乙酮从其与铝的化 合物中分离出来),用分液漏斗分出有机层、水层。每次用 5mL 甲苯萃取两次,并将所有甲苯层合并,然后依次 用水、10%氢氧化钠溶液、水各 10mL 洗涤有机层,最后用无水硫酸镁处理。
步骤 5:将干燥后的溶液滤入蒸馏瓶,减压蒸馏(整套装置必须是干燥的),收集 94℃(0.93kPa)馏分,得到对甲 基苯乙酮 4.1g。
请回答下列问题:
(1)仪器 x 的名称为________。与普通的分液漏斗相比,本实验采用仪器 x 的优点为_______。
(2)本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取哪些措施防止水解_____(答两点)。
(3)步骤③中最适宜的加热方式为 _____。
(4)步骤④中加入 10%的氢氧化钠溶液的目的为 _____,加入无水硫酸镁的目的为_________。
(5)步骤④中水层每次用 5mL 甲苯萃取两次并将所有甲苯层合并的目的为________。
(6)步骤⑤中减压蒸馏时所需的冷凝装置能否选用题给装置图中的球形冷能管_____(答“能”或“不能”)。 本实验中,对甲基苯乙酮的产率为_____(结果保留 2 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A.用向上排空气法收集NO
B.用装置甲配制100 mL 0.100 mol·L-1的硫酸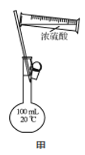
C.用装置乙蒸发CuCl2溶液可得到CuCl2固体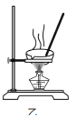
D.向含少量水的乙醇中加入生石灰后蒸馏可得到无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”时更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②![]() 容易失去电子转变为
容易失去电子转变为![]() ,表现出较强的还原性
,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为![]() 而不是
而不是![]()
④某种激发态碳(C)原子的电子排布式为![]() 而不是
而不是![]()
A.①③B.②③C.③④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com