
| Y | Z | M | |
| W |
 .
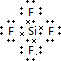
.
 .
.分析 X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,设M的原子序数为x,原子核外最外层电子数为x-2,则W的原子序数为x+5,则x+5=2(x-2),x=9,为F元素,则Z为O元素,Y为N元素、W为Si,以此解答该题.
解答 解:X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,设M的原子序数为x,原子核外最外层电子数为x-2,则W的原子序数为x+5,则x+5=2(x-2),x=9,为F元素,则Z为O元素,Y为N元素、W为Si,
(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故答案为:Si>N>O>F>H;
(2)W为Si元素,位于周期表第三周期、IVA族,Z为O,对应的离子核外有2个电子层,最外层电子数为8,离子结构示意图为 ,
,
故答案为:第三周期、IVA; ;
;
(3)H、N、O三种元素形成的化合物可以是NH4NO3(或NH4NO2),既有离子键又有共价键,为离子化合物,故答案为:NH4NO3(或NH4NO2);
(4)Si分别与F、O元素形成的化合物SiF4为分子晶体,SiO2属于原子晶体,SiF4沸点较低,电子式为 ,
,
故答案为:分子;原子; ;
;
(5)H分别与N、O、F、Si形成的常见化合物中,稳定性最好的是HF,结构式为H-F,稳定性最弱的物质为SiH4,具有甲烷的结构特点,为正四面体,
故答案为:H-F;正四面体;
(6)Y的单质为N2,电子式为 ,故答案为:
,故答案为: ;
;
(7)氢气、氧气在KOH的浓溶液中可以形成原电池,通入氧气的一极为正极,发生含有反应,碱性条件下生成水,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查结构性质位置关系应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原子的构成特点以及元素周期表知识,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )
瑞典皇家科学院2010年10月5日宣布,将2010年诺贝尔物理学奖授予荷兰籍物理学家安德烈•海姆和拥有英国与俄罗斯双重国籍的物理学家康斯坦丁•诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯结构如下图.它不仅是已知材料中最薄的一种,还非常牢固坚硬;作为单质,它在室温下传递电子的速度比已知导体都快.下列有关石墨烯的说法正确的是( )| A. | 石墨烯和石墨燃烧都生成二氧化碳,说明它们互为同分异构体 | |
| B. | 石墨烯一定条件下可与氢气发生反应生成石墨烷 | |
| C. | 石墨烯在室温下传递电子的速度快是因为碳原子间以极性键结合 | |
| D. | 12g石墨烯中含有NA个六元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家们正在研究利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气 | |
| B. | 贮氢金属在一定温度和压强下可以吸附氢气,如镧镍合金(LaNi5)可以吸附氢气形成LaNi5H6,其中H元素仍以H2分子形式存在 | |
| C. | 氢气因具有高热值、燃烧产物无污染等优点而被看成是理想的绿色能源 | |
| D. | 燃烧树枝取热、将植物秸杆制沼气、用淀粉制乙醇都是人们利用生物质能的方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和D具有相同的最简式 | |
| B. | A、B、C均含C、H、O三种元素,且含氧量A<B<C | |
| C. | B能与银氨溶液反应,生成光亮的银镜 | |
| D. | A、C均能与金属钠反应生成氢气,且等物质的量的A和C分别与足量钠反应生成的氢气A<C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


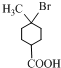 .
. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -218 kJ/mol | B. | -109 kJ/mol | C. | +218 kJ/mol | D. | +109 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1丙醇 | B. | 乙醇 | C. | 1丁醇 | D. | 1戊醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com