
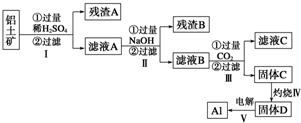
分析 SiO2和硫酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.铝土矿中加入硫酸,沉淀A为SiO2,滤液A中含有Al2(SO4)3、Fe(SO4)3,加入过量NaOH,沉淀B为Fe(OH)3,滤液B中含有NaAlO2,通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题,
(1)加入过量硫酸,Al2O3和Fe2O3与硫酸反应生成硫酸铝和硫酸铁;
(2)滤液A中含有Al2(SO4)3、Fe(SO4)3,加入过量NaOH,步骤 II生成滤液B为偏铝酸钠溶液;
(3)步骤V中发生反应是电解固体D氧化铝生成氧气和铝;
(4)偏铝酸钠溶液中通入过量二氧化碳反应生成氢氧化铝和碳酸氢钠;
(5)步骤 I也可以加入过量NaOH溶液代替硫酸,其中Al2O3溶液量SiO2和氢氧化钠溶液反应分别生成偏铝酸钠溶液和硅酸钠溶液.
解答 解:(1)加入过量硫酸,Al2O3和Fe2O3与硫酸反应生成硫酸铝和硫酸铁,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O;
(2)根据以上分析,滤液A中含有Al2(SO4)3、Fe(SO4)3,加入过量NaOH步骤 II生成滤液B为偏铝酸钠溶液,故反应的离子方程式为:4OH-+Al3+═AlO2-+2H2O,
故答案:4OH-+Al3+═AlO2-+2H2O;
(3)步骤V中发生反应是电解固体D氧化铝生成氧气和铝,反应的化学方程式是:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(4)步骤Ⅲ中生成固体C的反应是向滤液B中通入二氧化碳气体,又根据以上分析,滤液B中含有NaAlO2,故反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故答案:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)步骤 I也可以加入过量NaOH溶液代替硫酸,其中Al2O3溶液量SiO2和氢氧化钠溶液反应,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,SiO2+2NaOH=Na2SiO3+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O,SiO2+2NaOH=Na2SiO3+H2O;
点评 本题考查混合物的有关计算及反应方程式的书写,难度中等,清楚反应过程是解题的关键,注意守恒思想的运用,简化计算过程.


科目:高中化学 来源: 题型:选择题
| A. | 4mol/L | B. | 5mol/L | C. | 1 mol/L | D. | 20mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
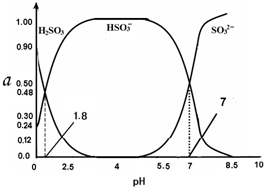 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铜片通过导线流向锌片 | B. | 锌片是正极,铜片上有气泡产生 | ||
| C. | 锌片逐渐溶解 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯均能发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 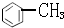 的一溴代物和 的一溴代物和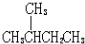 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | 乙酸乙酯、油脂、淀粉均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L | B. | 0.2L | C. | 0.5L | D. | 1.0L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com