
下列关于化学键与化合物的叙述正确的是
①离子化合物中一定含有金属元素 ②共价化合物中一定不含有金属元素 ③离子化合物中一定含有离子键 ④离子化合物中一定不含有共价键 ⑤离子化合物中可能含有共价键 ⑥共价化合物中可能含有离子键 ⑦共价化合物中一定不含有离子键
| A.①⑤⑥⑦ | B.②③④ | C.③⑤⑦ | D.②③⑥⑦ |
科目:高中化学 来源: 题型:问答题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。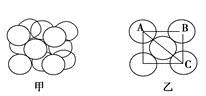
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于离子键、共价键的各种叙述中,下列说法正确的是 ( )
| A.在离子化合物里,只存在离子键,没有共价键 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,一定不存在离子键 |
| D.由不同元素组成的多原子分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H的电子式为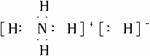 | B.NH4Cl的电子式为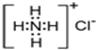 |
| C.NH4H含有极性共价键和离子键 | D.NH4H固体投入少量热水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.离子晶体中可能含有共价键,一定含有金属元素 |
| B.分子晶体中可能不含共价键 |
| C.非极性分子中一定存在非极性键 |
| D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法错误的是
| A.对羟基苯甲酸的沸点比邻羟基苯甲酸高,冰中既存在范德华力,又存在氢键 |
| B.简单立方是非密置层三维堆积形成的,面心立方是由密置层三维堆积形成的 |
| C.所有共价键都有方向性,形成氢键的三个相关原子可以不在直线上 |
| D.金属晶体的导电、导热性都与自由电子有关,离子晶体在一定条件下可以导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com