
| A. | 4L | B. | 8L | C. | 10L | D. | 12L |
分析 混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,利用差量法计算二氧化碳体积,然后计算出原混合气体中CO的体积.
解答 解:混合气体中只有CO2和Na2O2反应,反应方程式为2CO2+2Na2O2=2Na2CO3+O2,设二氧化碳体积为x,
2CO2+2Na2O2=2Na2CO3+O2 体积减少
44.8L 22.4L
x (20-16)L
则:44.8L:22.4L=x:(20-16)L
解得:x=8L
则原混合气体中CO的体积为:V(CO)=(20-8)L=12L,
故选D.
点评 本题考查混合物的有关计算,题目难度中等,明确反应中气体体积变化的根本原因是解本题关键,侧重考查学生分析计算能力,注意差量法的灵活运用.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
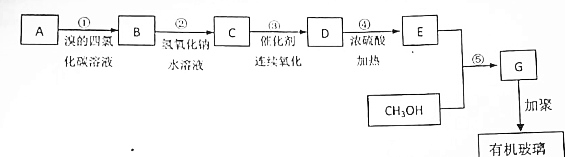
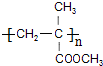 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 500℃左右比室温更有利于合成氨的反应(△H<0) | |
| C. | 红棕色的NO2加压后颜色先变深再变浅(2 NO2?N2O4(无色)) | |
| D. | 光照新制的氯水时,溶液的pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中得到8.96 L的气体 | B. | 最终得到的溶液中溶质为NaCl | ||
| C. | 最终Al元素全部以沉淀形式存在 | D. | 最终得到的溶液中n(NaCl)=0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
,A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1molNa2CO3含有的Na+离子数为2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液的pH | 加入盐酸的总体积 |
| 12 | V(HCl)=0 |
| 8 | V(HCl)=20.00mL |
| 5 | V(HCl)=40.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
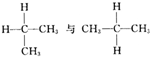
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com