
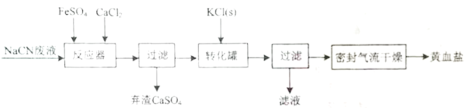
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
【答案】将绿矾溶于稀硫酸并加入少量铁粉 复分解反应 防止亚铁氰化钾被氧化 ![]()
根据电子得失守恒:![]()
![]()
根据电荷守恒:
![]()
![]()
![]()
![]()

![]()
亚铁氰化钾晶体的化学式为:![]()
【解析】
实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生反应,然后过滤除去CaSO4,经过滤后在转化罐中加入KCl进行转化,经过密封气流干燥,最后得到黄血盐,据此流程解答。
(1)用绿矾配制FeSO4溶液时,为防止Fe2+的水解和氧化,将绿矾溶于稀硫酸并加入少量铁粉,再用蒸馏水稀释,而不是直接溶解在水里,答案为:将绿矾溶于稀硫酸并加入少量铁粉;
(2)转化罐中加入KCl进行转化,得到溶解度比较小的钾盐,反应中元素的化合价都没有变化,属于化学反应中的复分解反应类型,答案为:复分解反应;
(3)亚铁氰化钾中的亚铁很容易被空气中的氧气氧化,故采用密封气流干燥取代在通风橱内干燥,答案为:防止亚铁氰化钾被氧化;
(4)根据反应过程中铁元素守恒可得:![]()
用KMnO4溶液滴定过程中铁由+2价变为+3价,碳元素由+2价变为+4价,氮元素由-3价变为+5价,发生氧化反应,高锰酸钾中锰元素由+7价变为+2价,发生还原反应,根据电子得失守恒:![]() ,所以
,所以![]()
根据KxFey(CN)znH2O中的电荷守恒可得:![]()
KxFey(CN)znH2O中各元素的质量分别为:![]() ;
;
![]() ;
;
![]() ;
;
水的质量为: ,
,
黄铁盐KxFey(CN)znH2O中各粒子物质的量之比为:![]() ,所以黄血盐即亚铁氰化钾晶体的化学式为:
,所以黄血盐即亚铁氰化钾晶体的化学式为:![]() 。
。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3<Na2CO3
B.在水中的溶解性:NaHCO3<Na2CO3
C.与盐酸反应的速率:NaHCO3<Na2CO3
D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
D.该温度下此反应的平衡常数K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
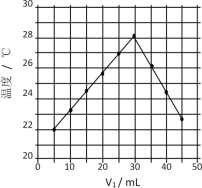
A.做该实验时环境温度低于22℃
B.该实验表明化学能可能转化为热能
C.该实验表明有水生成的反应一定是放热反应
D.NaOH溶液的浓度约为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L 盐酸与50 mL0.55mol/LNaOH溶液,在右图装置中进行中和热的测定,请回答下列问题:
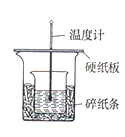
(1)从实验装置看,图中尚缺少的一种玻璃用品是________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是________。
(3)做1次完整的中和热测定实验,温度计需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?________。
(4)某同学实验记录数据如下表所示假设盐酸和氢氧化钠溶液的密度都是1g/mL,又知中和反应后生成溶液的比热容c=4.18J/(g.℃)根据该同学的实验数据计算,该实验测的中和热△H=________。
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | |||
HCl | NaOH | ||||
1 | 20.0 | 20.1 | 23.2 | ||
2 | 20.2 | 20.4 | 23.4 | ||
3 | 20.5 | 20.6 | 23.6 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag氧化铁和硫化亚铁组成的混合物溶解在足量的稀盐酸中,结果得到bg沉淀,则原混合物中硫化亚铁的质量可能为( )
A.5bgB.(a5b) gC.(a 11b/4)gD.11b/4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
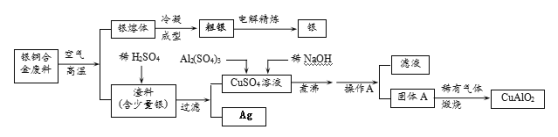
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
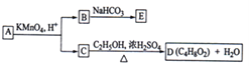
A.B的结构简式为HOOCCH2COOHB.C与乙醇发生了酯化反应
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com