
【题目】【化学一选修3: 物质结构与性质】
(1)CH3COONH2 分子中各元素第一电离能大小顺序__________,该物质中碳原子杂化方式为_______________________________。
(2)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4) 等弱碱。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
比较上表中氨(NH3)、联氨(N2H4) 的熔、沸点,解释其高低的主要原因________,![]() 的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
(3)浅红色Cr [(H2O)3(NH3)3]Cl3中铬离子价电子排布式为__________________。
(4)SiC具有高硬度,高耐磨性,高耐腐蚀性和较高的高温强度特点,已成为一种重要的工程材料,其晶体具有六方ZnS 型结构。晶胞参数a=308pm,c=505pm,已知C原子的分数坐标(0,0,0)和(![]() ,
,![]() ,
,![]() );Si原子的分数坐标(0,0,
);Si原子的分数坐标(0,0,![]() )和((
)和((![]() ,
,![]() ,
,![]() )
)
①按比例在下框中商出SiC 六方晶胞_______

②列式计算Si-C的键长_______(保留整数部分)
【答案】 N>O>H>C SP3杂化、SP2杂化 联氨分子间形成的氢键数目多于氨分子间形成的氢键 ![]() H3O+ 3d3
H3O+ 3d3 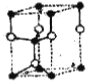 黑球是碳,白球是硅 dsi-c=(1-
黑球是碳,白球是硅 dsi-c=(1-![]() )c=
)c=![]() ×505pm=189pm
×505pm=189pm
【解析】(1)CH3COONH2所含四种元素分别为N、H、C、O,同一主族,从上到下,第一电离能减小,同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但是氮元素的2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能大于同周期的相邻元素,所以四种元素第一电离能由大到小的顺序为:N>O>H>C ; CH3COONH2中甲基中的C原子 sp杂化,羧基中的C原子 sp杂化;正确答案:N>O>H>C; sp杂化、sp杂化 。
(2)氨和联氨分子间均存在氢键,但联氨分子间形成的氢键数目多于氨分子间形成的氢键,故联氨的沸点明显高于氨; ![]() 分子中,6个碳的P轨道,每个碳含有1个电子,1个氮的P轨道,含有2个未参与成键的电子,因此大π键中含有的电子数为8,参与形成π键的原子数为7,所以
分子中,6个碳的P轨道,每个碳含有1个电子,1个氮的P轨道,含有2个未参与成键的电子,因此大π键中含有的电子数为8,参与形成π键的原子数为7,所以![]() 的离域π键表示为
的离域π键表示为![]() ;原子数、总电子数均相等的物质,其结构相似,物理性质相近,相应的物质称为等电子体,所以与NH3互为等电子体的阳离子有H3O+;正确答案:联氨分子间形成的氢键数目多于氨分子间形成的氢键;
;原子数、总电子数均相等的物质,其结构相似,物理性质相近,相应的物质称为等电子体,所以与NH3互为等电子体的阳离子有H3O+;正确答案:联氨分子间形成的氢键数目多于氨分子间形成的氢键; ![]() ; H3O+。
; H3O+。
(3)根据化合价法则,Cr[(H2O)3(NH3)3]Cl3中铬为+3价,铬原子核外电子排布为ls22s22p63s23p63d54s1,Cr3+价电子排布式为3d3;
(4)①SiC六方晶胞的轴比c/a=505pm/308pm=1.64,Si原子和C原子的共价半径分别为113 pm和77 pm,参照这些数据和原子的坐标参数,画出SiC的六万晶胞如下图所示: 黑球是碳,白球是硅 ;正确答案:
黑球是碳,白球是硅 ;正确答案: 黑球是碳,白球是硅。
黑球是碳,白球是硅。
②由上图中的晶胞图可知,Si-C键键长为dsi-c=(1-![]() )c=
)c=![]() ×505pm=189pm;正确答案:189pm。
×505pm=189pm;正确答案:189pm。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。其球棍模型如图所示,关于咖啡酸的下列说法正确的是
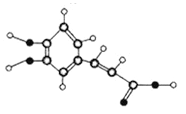
A. 分子式为C9H10O4
B. 分子中至少有9个碳原子共平面
C. 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2
D. 1 mol咖啡酸最多能够与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是 ( )
A. pH=7的溶液
B. c(H+)=c(OH-)的溶液
C. 由强酸、强碱等物质的量反应得到的溶液
D. 非电解质溶于水得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马拉松长跑运动员在进入冲刺阶段时,发现少数运动员下肢肌肉发生抽搐,这是由于随着大量排汗而向外排出了过量的
A. 水 B. 钙盐 C. 钠盐 D. 尿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的O2在密闭容器中点燃,充分反应后,CH4和O2均无剩余,且产物均为气体(101kPa,120℃ ),总质量为72g,下列有关叙述不正确的是
A. 若将产物通过碱石灰,则不能被完全吸收
B. 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g
C. 产物的平均摩尔质量为24g.mol-1
D. 反应中消耗O256g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是 ______ .
A.一定含有-OH B.一定含有-COOH C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作 ______ .
(3)A与钠反应的化学方程式: ________________________________________ .
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为:________________ .
(5)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:___________________.
(6)如图是B分子的球棍模型和A分子的比例模型,若A和B的关系是同系物,则B的结构简式 ______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com