
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
分析 氧元素被还原,则氧元素得电子,化合降低,由此分析解答.
解答 解:A、2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2反应氧元素的化合价降低,所以氧元素被还原,故A正确;
B、氧化钠与水反应生成氢氧化钠,非氧化还原反应,故B错误;
C、2F2+2H2O═4HF+O2反应中水中氧元素的化合价升高是被氧化,故C错误;
D、2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si反应中氧元素的化合价不变,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,题目难度不大,明确反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意从元素化合价角度分析,试题培养了学生的分析、理解能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
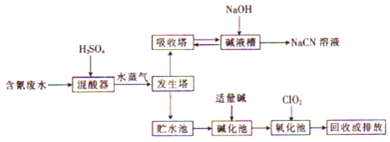
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池反应为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时负极质量减轻 | |
| B. | 电解精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COONa稀溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ 的值增大 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
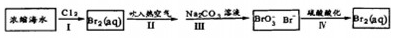
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
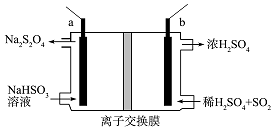 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )| A. | b电极应该接电源的负极 | |
| B. | 装置中所用离子交换膜为阴离子交换膜 | |
| C. | 电路中每转移1mole-消耗SO2的体积为11.2L | |
| D. | a电极的电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
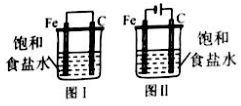
| A. | 两个装置中Fe棒上发生的反应相同 | |
| B. | 图 I中铁比图 II中铁腐蚀更快 | |
| C. | 两个装置中C棒上均明显有气体逸出 | |
| D. | 两个装置中Fe均是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
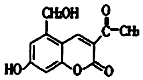 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
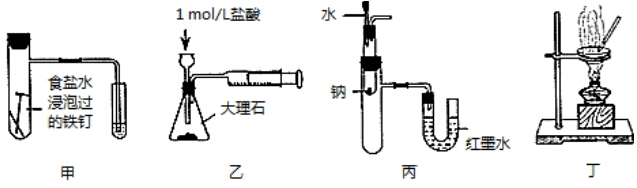
| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
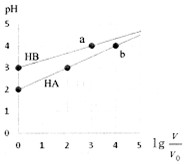 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 水的电离程度a点大于b点 | |
| C. | 当pH=2时,HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9 | |
| D. | 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com