
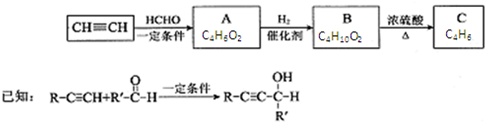
 ,其反应类型消去反应.
,其反应类型消去反应. 分析 由A的分子式结合信息,可知1分子甲醛与2分子乙炔发生加成反应生成A,则A的结构简式为HOCH2C≡CCH2OH,A与氢气发生加成反应生成B为HOCH2CH2CH2CH2OH,B再浓硫酸作用下发生消去反应生成CH2=CHCH=CH2,据此答题.
解答 解:由A的分子式结合信息,可知1分子甲醛与2分子乙炔发生加成反应生成A,则A的结构简式为HOCH2C≡CCH2OH,A与氢气发生加成反应生成B为HOCH2CH2CH2CH2OH,B再浓硫酸作用下发生消去反应生成CH2=CHCH=CH2,
(1)A的结构简式为HOCH2C≡CCH2OH,含有官能团的名称是:羟基、碳碳三键,
故答案为:羟基;碳碳三键;
(2)A的一种同分异构体属于乙酸酯,根据酯的构成,醇的部分应是乙烯醇,所以其结构简式为:CH3COOCH=CH2,
故答案为:CH3COOCH=CH2;
(3)B应为1,4-丁二醇,在浓硫酸催化下发生消去反应,化学方程式为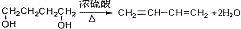 ,
,
故答案为: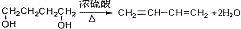 ;消去反应.
;消去反应.
点评 本题考查有机物的推断与合成,注意根据反应信息与A的分子式推断其结构,再利用顺推法推断B、C,侧重考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若两种恰好中和,则一定是a=b | B. | 若混合液显碱性,则一定是b≥a | ||
| C. | 若混合液显中性,则可能有a>b | D. | 若混合液显酸性,则可能有a≤b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
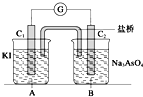 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 8 | C. | 12 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵 | |
| C. | 某小组研究人员成功制备出了四氧化铱正离子(IrO4+),其球棍模型为 ,由此可判断其中铱元素显+9价 ,由此可判断其中铱元素显+9价 | |
| D. | 门捷列夫根据元素性质随元素的相对原子质量递增而显现元素周期性变化的规律排出了第一张元素周期表 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com