
| ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖł ŠčŹ±¼ä/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
·ÖĪö £Ø1£©øĆ·“Ó¦ŹĒŅ»øö·“Ó¦Ē°ŗóĘųĢåĢå»żŌö“óµÄĪüČČ·“Ó¦£¬ÉżøßĪĀ¶Č”¢¼õŠ”Ń¹Ē攢¼õÉŁÉś³ÉĪļµÄĮ涼ÄÜŹ¹Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£»
£Ø2£©ŅĄ¾Ż»ÆŃ§Ę½ŗāČżŠŠ¼ĘĖćĮŠŹ½¼ĘĖćĘ½ŗāÅØ¶Č£¬Ę½ŗā³£ŹżK=$\frac{Éś³ÉĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż}{·“Ó¦ĪļĘ½ŗāÅضČĆŻ“Ī·½³Ė»ż}$£»
£Ø3£©ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŗĶøĒĖ¹¶ØĀɼĘĖćĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½£¬Č¼ÉÕČČŹĒ1molæÉČ¼ĪļĶźČ«Č¼ÉÕÉś³ÉĪȶØŃõ»ÆĪļ·Å³öµÄČČĮ森
½ā“š ½ā£ŗ£Ø1£©A£®ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬H2²śĀŹŌö“󣬹ŹAÕżČ·£»
B£®Ōö¼ÓĢ¼µÄÓĆĮ棬ÅØ¶Č²»±ä£¬Ę½ŗā²»ŅĘ¶Æ£¬¹ŹB“ķĪó£»””
C£®¼ÓČė“߻ƼĮ£¬Ę½ŗā²»ŅĘ¶Æ£¬¹ŹC“ķĪó£»
D£®ÓĆCOĪüŹÕ¼Į³żČ„CO£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬H2²śĀŹŌö“󣬹ŹDÕżČ·£»””
¹Ź“š°øĪŖ£ŗAD£»
£Ø2£©CO£Øg£©+H2O£Øg£©ØTCO2£Øg£©+H2£Øg£©
ĘšŹ¼Įæ£Ømol/L£© 1 0.5 0 0
±ä»ÆĮæ£Ømol/L£© 0.2 0.2 0.2 0.2
Ę½ŗāĮæ£Ømol/L£© 0.8 0.3 0.2 0.2
Ę½ŗā³£ŹżK=$\frac{0.2”Į0.2}{0.6”Į0.3}$=$\frac{2}{9}$=0.22£¬
“š£ŗøĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ0.22£»
£Ø3£©¢ŁN2£Øg£©+3H2£Øg£©ØT2NH3£Øg£©”÷H=-92.4kJ/mol-1
¢Ś2N2£Øg£©+6H2O£Øl£©ØT4NH3£Øg£©+3O2£Øg£©”÷H=+1530.0kJ/mol
£Ø¢Ł”Į2-¢Ś£©”Į$\frac{1}{6}$µĆµ½£ŗH2£Øg£©+$\frac{1}{2}$O2£Øg£©=H2O£Øl£©”÷H=-285.8kJ/mol
¹Ź“š°øĪŖ£ŗ-285.8 kJ/mol£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓ°ĻģĘ½ŗāŅņĖŲ·ÖĪöÅŠ¶Ļ”¢ČČ»Æѧ·½³ĢŹ½ŹéŠ“ŗĶ¼ĘĖć£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A | B | C | D | |
| ŹµŃé×°ÖĆ | 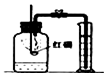 ²ā¶ØæÕĘųÖŠŃõĘųŗ¬Įæ | 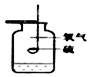 ĮņŌŚŃõĘųÖŠČ¼ÉÕ | 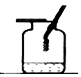 ĢśĖæŌŚŃõĘųÖŠČ¼ÉÕ | 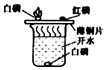 Ģ½¾æČ¼ÉÕµÄĢõ¼ž |
| ½āŹĶ | ĮæĶ²ÖŠĖ®£ŗĶعżĖ®Ģå»żµÄ±ä»ÆµĆ³öO2µÄĢå»ż | ¼ÆĘųĘæÖŠµÄĖ®£ŗĪüŹÕ·Å³öµÄČČĮæ | ¼ÆĘųĘæÖŠµÄĖ®£ŗĄäČ“½¦ĀäČŪČŚĪļ£¬·ĄÖ¹¼ÆĘųĘæÕØĮŃ | ÉÕ±ÖŠµÄĖ®£ŗ¼ÓČČĶʬ£»øō¾ųæÕĘų |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ³ĀŹöI | ³ĀŹöII |
| A | Fe2O3ŹĒŗģ×ŲÉ«·ŪÄ© | Fe2O3³£×öŗģÉ«ĶæĮĻ |
| B | SiO2ŹĒĮ½ŠŌŃõ»ÆĪļ | SiO2æÉŗĶHF·“Ó¦ |
| C | Al2O3ÄŃČÜÓŚĖ® | Al2O3æÉÓĆ×÷ÄĶ»š²ÄĮĻ |
| D | SO2ÓŠĘư׊Ō | SO2æÉŹ¹äåĖ®ĶŹÉ« |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
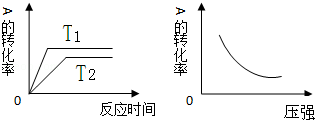
| A£® | Q£¼0£¬m+n£¼x | B£® | Q£¼0£¬m+n£¾x | C£® | Q£¾0£¬m+n£¼x | D£® | Q£¾0£¬m+n£¾x |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāĘųµÄČ¼ÉÕČČ”÷H=-241.6 kJ•mol-1 | |
| B£® | µČÖŹĮæµÄH2”¢COĶźČ«Č¼ÉÕŹ±£¬COŹĶ·ÅµÄČČĮæøü¶ą | |
| C£® | ĆŗµÄĘų»ÆµÄČČ»Æѧ·½³ĢŹ½ĪŖC£Øs£©+H2O£Øg£©ØTCO£Øg£©+H2£Øg£©”÷H=-131.1 kJ•mol-1 | |
| D£® | ĆŗĢæĶźČ«Č¼ÉÕŹĶ·Å1967.5 kJČČĮæŹ±×ŖŅĘ20 molµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
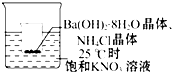 °ŃŠ”ÉÕ±·ÅČė25”ęµÄŹ¢ÓŠ±„ŗĶĻõĖį¼ŲČÜŅŗµÄ“óÉÕ±ÖŠ£¬Š”ÉÕ±£ØŅѱ»Éč·Ø¹Ģ¶Ø£©ÖŠ·ÅÓŠ 25gŃŠ³É·ŪÄ©µÄĒāŃõ»Æ±µ¾§Ģå[Ba£ØOH£©2•8H2O]£¬ŌŁ¼ÓČėŌ¼12gµÄĀČ»Æļ§¾§Ģ壬²¢½Į°čŹ¹Ęä³ä·Ö·“Ó¦£®
°ŃŠ”ÉÕ±·ÅČė25”ęµÄŹ¢ÓŠ±„ŗĶĻõĖį¼ŲČÜŅŗµÄ“óÉÕ±ÖŠ£¬Š”ÉÕ±£ØŅѱ»Éč·Ø¹Ģ¶Ø£©ÖŠ·ÅÓŠ 25gŃŠ³É·ŪÄ©µÄĒāŃõ»Æ±µ¾§Ģå[Ba£ØOH£©2•8H2O]£¬ŌŁ¼ÓČėŌ¼12gµÄĀČ»Æļ§¾§Ģ壬²¢½Į°čŹ¹Ęä³ä·Ö·“Ó¦£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŠņŗÅ | ĪļÖŹ | ŹŌ¼Į | ·ÖĄė·½·Ø |
| ¢Ł | ĻõĖį¼Ų£ØĀČ»ÆÄĘ£© | ÕōĮóĖ® | ÖŲ½į¾§ |
| ¢Ś | ¶žŃõ»ÆĢ¼£ØĀČ»ÆĒā£© | ±„ŗĶĢ¼ĖįÄĘČÜŅŗ | Ļ“Ęų |
| ¢Ū | ŅŅ“¼£ØĖ®£© | ½šŹōÄĘ | ÕōĮó |
| ¢Ü | NaClČÜŅŗ£ØNa2S£© | AgCl | ¹żĀĖ |
| A£® | ¢Ł¢Ū | B£® | ¢Ł¢Ü | C£® | ¢Ś | D£® | ¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com