
(7分)铜与浓硝酸反应的化学方程式如下:ZxxkCu +4HNO3(浓)==Cu(NO3)2+2 NO2↑+2H2O将 3.2 g铜完全溶于足量的 50 mL 11.0 mol?L-1的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50 mL。试计算
(1)反应后可生成标准状况下NO2气体多少 L? (写计算过程)
(2)反应后溶液中NO3-物质的量浓度为_________________________。
(4分) (1)2.24L (2分) 格式2分 (2) 9 mol?L-1 (3分)(单位漏写扣1分)
解析试题分析:(1)3.2g铜是3.2g÷64g/mol=0.05mol、硝酸的物质的量是0.05mol×11mol/L=0.55mol。根据浓硝酸和铜反应的方程式是Cu +4HNO3(浓)=Cu(NO3)2+2 NO2↑+2H2O,所以0.05mol铜需要0.05mol×4=0.2mol,所以硝酸是过量的。生成NO2是0.05mol×2=0.1mol,在标准状况下的体积是0.1mol×22.4L/mol=2.24L。
(2)根据氮原子守恒可知,反应后溶液中NO3-的物质的量是0.55mol-0.1mol=0.45mol。溶液的体积是50ml,所以反应后溶液中NO3-物质的量浓度为0.45mol÷0.05L=9.0mol/L。
考点:考查根据反应的方程式进行的有关计算
点评:由于反应物的物质的量都是已知的,所以该题在计算时首先需要讨论过量问题。即计算NO2的体积时必需是以完全参加反应的物质的物质的量为标准。其次在计算时应该利用好守恒法,以简化计算过程。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
![]()
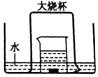 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
![]() (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是:
![]() ①_______________________________ ;
①_______________________________ ;
![]() ②_______________________________ ;
②_______________________________ ;
![]() ③_______________________________ ;
③_______________________________ ;
![]() ④_______________________________ 。
④_______________________________ 。
![]() (3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
![]() (4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期期中考试化学试卷(解析版) 题型:计算题
(7分)铜与浓硝酸反应的化学方程式如下:ZxxkCu +4HNO3(浓)==Cu(NO3)2+2 NO2↑+2H2O将 3.2 g铜完全溶于足量的 50 mL 11.0 mol•L-1 的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50 mL。试计算
(1) 反应后可生成标准状况下NO2气体多少 L? (写计算过程)
(2)反应后溶液中NO3-物质的量浓度为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com