
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是 ( )
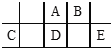
A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. 简单离子的半径由大到小为:E>A>B>C
D. D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
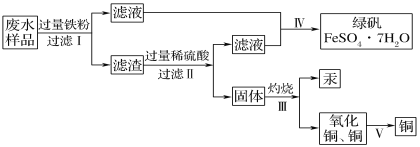
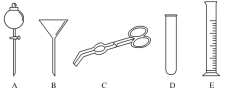
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的仪器是________(填序号);
(2)步骤Ⅰ中加入过量铁粉的目的是________;步骤Ⅱ中________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤Ⅲ的实验装置如图所示,加热装置应与装置________(填“甲”“乙”或“丙”)连接,理由是_____________
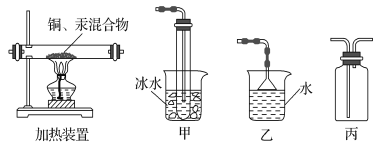
(4)利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案________(填“甲”“乙”或“丙”,下同)不好;从产品纯度考虑,方案________不好。
(5)写出步骤Ⅰ中涉及反应的离子方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置进行实验,下列说法错误的是

A. 若使图(1)装置中的Zn棒和Cu棒直接接触,则Cu棒上能看到有气体产生
B. 图(2)装置中SO42-向着Zn棒移动
C. 若将图(2)装置中Zn改为Mg,则Cu棒上产生气体的速率加快
D. 当图(2)装置与图(3)装置中正极生成物的质量比为1∶16时,两装置中Zn棒减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是

A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有 SO2和 NOx,形成酸雨、污染大气。
(1)采用 NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有 SO2和 NO 的烟气,写出 NaClO2溶液脱硝过程中主要反应的离子方程式______________.
(2)NO2与SO2能发生反应:NO2+SO2 ![]() SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
SO3+NO,在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(N02) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。 部分实验结果如图所示:
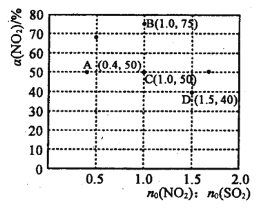
①当容器内________(填标号)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.N02的体积分数
e.气体的颜色
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是__________。
③图中C、D两点对应的实验温度分别为Tc和Td,试判断: Tc_____Td(填“>”、“=”或“<”)。
(3)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g) + O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则 NO2(g)+SO2(g) ![]() SO3(g)+NO(g) △H= ________.
SO3(g)+NO(g) △H= ________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:①O2和O3;②![]()
![]()
![]() ;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和
;③H2O、D2O、T2O;④C16H34和(CH3)2CHCH2CH3;⑤CH3(CH2)3CH3和![]() ;⑥2-甲基丁烷、异戊烷。
;⑥2-甲基丁烷、异戊烷。
其中互为同位素的是_______;互为同素异形体的是_______;互为同系物的是_______;互为同分异构体的是_______;属于同种物质的是_______。(用序号填空,下同)
(2)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
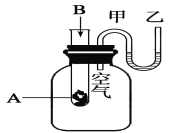
①该反应为______反应(填“放热”或“吸热”)。
②A和B的总能量比C和D的总能量___(填“高”或“低”)。
③物质中的化学能通过______转化成______释放出来。
④反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
⑤写出一个符合题中条件的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com