
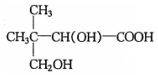 $→_{△}^{浓硫酸}$
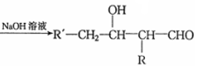
$→_{△}^{浓硫酸}$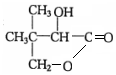 +H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为
+H2O.F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为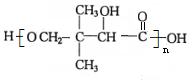 .
.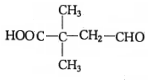 .
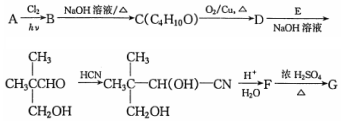
. 分析 A是相对分子质量为58的链状烃,分子碳原子最大数目=$\frac{58}{12}$=4…10,故A的分子式为C4H10,且其核磁共振氢谱上的峰面积之比为9:1,故A的结构简式为CH(CH3)3.A发生取代反应生成B,B发生卤代烃水解反应生成C为醇,C发生催化氧化生成D,结合信息①及D与E反应生成物结构简式,可推知B为(CH3)2CHCH2Br,C为(CH3)2CHCH2OH,D为(CH3)2CHCHO,E为HCHO.结合信息②可推知F为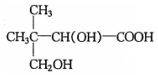 ,F发生酯化反应生成G为五元环化合物,则G为
,F发生酯化反应生成G为五元环化合物,则G为 .
.
解答 解:A是相对分子质量为58的链状烃,分子碳原子最大数目=$\frac{58}{12}$=4…10,故A的分子式为C4H10,且其核磁共振氢谱上的峰面积之比为9:1,故A的结构简式为CH(CH3)3.A发生取代反应生成B,B发生卤代烃水解反应生成C为醇,C发生催化氧化生成D,结合信息①及D与E反应生成物结构简式,可推知B为(CH3)2CHCH2Br,C为(CH3)2CHCH2OH,D为(CH3)2CHCHO,E为HCHO.结合信息②可推知F为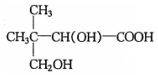 ,F发生酯化反应生成G为五元环化合物,则G为
,F发生酯化反应生成G为五元环化合物,则G为 .
.
(1)D为(CH3)2CHCHO,分子中含有的官能团名称是醛基,故答案为:醛基;
(2)B发生卤代烃水解反应生成C,C发生醇的催化氧化生成D,B→D反应过程中涉及的反应类型有:取代反应和氧化反应,故答案为:取代反应和氧化反应;
(3)由上述分析可知,A的结构简式为CH(CH3)3,E的结构简式为HCHO,故答案为:CH(CH3)3;HCHO;
(4)F→G的化学方程式为: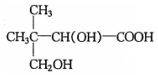 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为:
+H2O,F能发生缩聚反应,则生成链节的主链上有四个碳愿子的高分子化合物的结构简式为: ,
,
故答案为: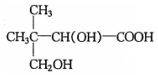 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O; ;
;
(5)G( )的同分异构体同时满足下列条件:①能发生银镜反应,说明含有醛基,②能与NaHCO3发生反应,说明含有羧基,可以看做丁烷被-CHO、-COOH取代,正丁烷被取代,-COOH取代甲基中H原子时,-CHO有4种位置,-COOH取代亚甲基中H原子时,-CHO有4种位置.异丁烷被取代,-COOH甲基中H原子时,-CHO有3种位置,-COOH取代次甲基中H原子时,-CHO有1种位置,故符合条件的同分异构体共有12种,其中核磁共振氢谱为4组峰的结构简式为:
)的同分异构体同时满足下列条件:①能发生银镜反应,说明含有醛基,②能与NaHCO3发生反应,说明含有羧基,可以看做丁烷被-CHO、-COOH取代,正丁烷被取代,-COOH取代甲基中H原子时,-CHO有4种位置,-COOH取代亚甲基中H原子时,-CHO有4种位置.异丁烷被取代,-COOH甲基中H原子时,-CHO有3种位置,-COOH取代次甲基中H原子时,-CHO有1种位置,故符合条件的同分异构体共有12种,其中核磁共振氢谱为4组峰的结构简式为: ,
,
故答案为:12; .
.
点评 本题考查有机物的推断,充分利用有机物的结构简式、分子式与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,(5)中同分异构体数目判断为易错点,是对有机化学基础的综合考查,难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 催化剂 V2O5 不改变该反应的逆反应速率 | |
| B. | 恒压,通入稀有气体,反应速率不变 | |
| C. | 该反应是放热反应,降低温度反应速率变大 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO2 (g)消耗的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 0.56L | C. | 0.448L | D. | 0.224L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 1mol甲基的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y>X>Z>W | B. | W>X>Z>Y | C. | X>Y>Z>W | D. | Y>Z>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(12-3n) | B. | -(3n-12) | C. | -(3n-4) | D. | -(n-10) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸与氢氧化钠反应能生成2种盐 | |
| B. | NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐 | |
| C. | H3PO4、H3PO3、H3PO2都是含氧酸 | |
| D. | H3PO3是三元酸,又是还原性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | △H<0、△S<0的反应在高温条件下能自发进行 | |
| C. | 反应CaCO3(s)=CaO(s)+CO2(g)的△S<0 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com