
【题目】分子式为C2H4 O2 的物质,有多种同分异构体,其分子能发生银镜反应的结构有( )
A.1种B.2种C.3种D.4种
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是,A、B、C、D的第一电离能由小到大的顺序为。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是。
(3)A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的空间构型是。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定.工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 .
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅.一种合成氮化硅的工艺主要流程如图: 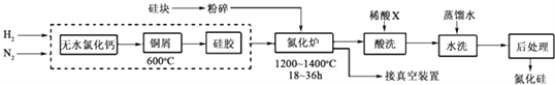
①净化N2和H2时,铜屑的作用是:;硅胶的作用是 .
②在氮化炉中3SiO2(s)+2N2(g)═Si3N4(s)△H=﹣727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度;体系中要通入适量的氢气是为了 .
③X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”).
(3)工业上可以通过如图所示的流程制取纯硅:
①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式 .
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是 . 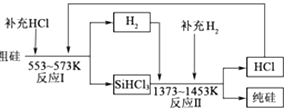
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH ![]() Na2SiO3+H2O
Na2SiO3+H2O
B.在海带灰的浸出液(含有I﹣)中滴加H2O2得到I2:2I﹣+H2O2+2H+═I2+O2↑+2H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵“(主要成分盐酸)混合使用放出氯气:ClO﹣+Cl﹣+2H+═Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年初天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2 . ①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释: .
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
写出HSO3﹣在阳极放电的电极反应式: , 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJmol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏伽德罗常数的值用NA表示),放出的热量为kJ.
(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2 , 发生如下两个反应: ①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10﹣3mol/(Lmin).下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2
B.平衡后c(Cl2)=2.5×10﹣2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。
(1)其中被还原的元素是 , 被氧化的元素是 , 氧化剂是 , 还原剂是 , 氧化产物是 , 还原产物是。
(2)用双线桥标出电子转移的方向和数目:2KNO3+ 3C+ S ═ K2S + N2↑+ 3CO2↑。
(3)当0.1molCO2生成时,则转移的电子数为个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com