
| A.ρ1>ρ2 | B.ρ1=ρ2 | C.ρ1<ρ2 | D.无法确定 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
| B.在pH=12的溶液中:NH+4、K+、ClO-、Cl- |
| C.有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-[来源:] |
| D.在碳酸氢钠的溶液中:K+、SO2-4、Cl-、CO2-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- |
| B.c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42—、NO3- |
| C.在加入铝粉后能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D.含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同 |
| B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7 |
| C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 |
| D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.0.1mol/LNaHCO3溶液中,c(OH-)-C(H+)=c(H2CO3)-c(CO32-) | B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 | C.A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 | D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
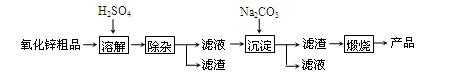
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 指定环境 | 能够共存的离子 |
| A | 滴加酚酞显红色的溶液 | K+、 S2—、 SO32—、NO3— |
| B | 有HCO3—存在的无色透明溶液 | Na+、K+、Cl—、Al3+ |
| C | 水电离的c(H+)=10—12 mol/L的溶液中 | C1—、CO32—、NO3—、NH4+ |
| D | 使石蕊变红的溶液中 | Fe2+、MnO4—、NO3—、SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。 CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。 _____________。
_____________。 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)| A.不移动 | B.向正反应方向移动 |
| C.向逆反应方向移动 | D.无法判断移动的方向 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com