
 钙、铝、铜都是中学化学中常见的金属元素.
钙、铝、铜都是中学化学中常见的金属元素.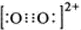 ,在1个O22+含有2个π键,故答案为:
,在1个O22+含有2个π键,故答案为: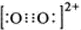 ;2;
;2;| 1 |
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4 |
| NA |
| m |
| V |
| ||
16
|
| M | ||
4
|
| M | ||
4
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 阳离子 | K+Ag+ Ba 2+ A13+Fe3+ |
| 阴离子 | OH - C1- SO42-NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
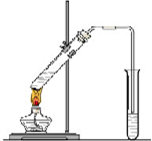 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
A、检验溶液中是否有SO
| ||
| B、检验溶液中是否有K+时,用灼烧过的铂丝蘸取试液,观察焰色是否呈紫色 | ||
C、检验溶液中是否有NO
| ||
D、检验溶液中是否含有CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
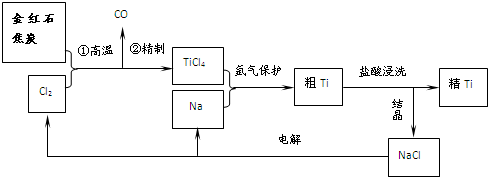
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com