
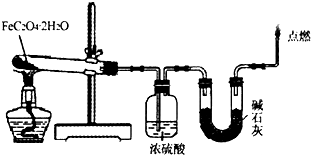
 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(A)平:V(B)平=5:3 |
| B、A的转化率为20% |
| C、x:y=2:1 |
| D、D的反应速率为0.25 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
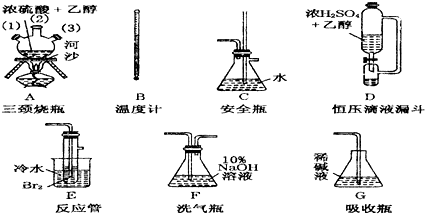
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲和丁的最简式相同 |
| B、丁的分子量是丙的两倍 |
| C、甲既可是饱和一元醛,又可是饱和一元酮 |
| D、甲的分子中一定具有甲基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com