
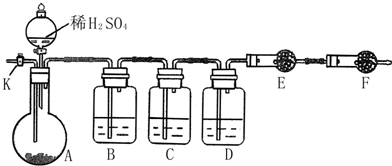
分析 由装置图可知,实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳加入E装置中,影响测量结果;
(3)实验测定Na2CO3与Na2SO3混合物中各组分的含量,样品和酸反应生成的气体为二氧化碳和二氧化硫气体,利用B装置除去二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,为避免二氧化硫气体对测定结果的干扰,装置C作用是用品红试液验证二氧化硫是否被除净;
(4)实验原理是除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,所以进入装置E中的二氧化碳要干燥、不含二氧化硫,装置B的作用是除去气体中的二氧化硫,试剂全部吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳;装置C的作用是验证二氧化硫是否除尽,装置D的作用是干燥气体;
(5)装置内会残留部分二氧化碳,应使二氧化碳全部被装置E中药品吸收,故通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部进入装置E中药品吸收;由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的Na2S03质量减小;
(6)装置E在实验完成时增重4.4g为二氧化碳的质量,物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,亚硫酸钠物质的量为$\frac{12.6g}{126g/mol}$=0.1mol,据此计算.
解答 解:分析可知实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
故答案为:检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;
利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳加入E装置中,影响测量结果;
故答案为:托盘天平;防止空气中的水蒸气、二氧化碳加入E装置中;
(3)样品和酸反应生成的气体为二氧化碳和二氧化硫气体,利用B装置除去二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,所以装置C的作用是用品红试液验证二氧化硫是否被B吸收完全;有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,是基于二氧化碳能溶于水;
故答案为:检验SO2是否被B吸收完全;CO2可溶于水;
(4)实验原理是除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,故进入装置E中的二氧化碳要干燥、不含二氧化硫,所以装置B的作用是除去气体中的二氧化硫,试剂是吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳,分析选项中试剂可知应选择c.酸性高锰酸钾溶液;装置C的作用是验证二氧化硫是否除尽,装置D的作用是干燥气体,选择试剂为a(浓硫酸),E和F装置中是盛碱石灰的干燥管,利用E装置的增重确定生成的二氧化碳的质量,F为了排除空气中的二氧化碳,水蒸气进入装置E产生误差;
故答案为:c;a;g;
(5)装置内会残留部分二氧化碳,应使二氧化碳全部被装置E中药品吸收,所以通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部被装置E中药品吸收;由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的Na2S03质量减小,导致Na2SO3含量偏低,可以使空气先通过e氢氧化钠溶液,除去含有的二氧化碳;
故答案为:使生成的二氧化碳能够全部装置E中药品吸收;e;偏低;
(6)装置E在实验完成时增重4.4g为二氧化碳的质量,物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,物质的量为$\frac{12.6g}{126g/mol}$=0.1mol,所以则Na2CO3与Na2SO3的物质的量之比为0.1mol:0.1mol=1:1,
故答案为:1:1.
点评 本题考查学生对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| B. | 工业生产玻璃和水泥,均需要用石灰石为原料 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 海水淡化是解决淡水供应危机的方法之一,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液与铜反应:Cu+Ag+═Cu2++Ag | |
| B. | 氧化镁与盐酸反应:O2-+2H+═H2O | |
| C. | 碳酸钙与盐酸反应:CO${\;}_{3}^{2-}$+2H+═H2O+CO2↑ | |
| D. | Fe(OH)3加入H2SO4溶液中:3H++Fe(OH)3═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率,属于牺牲阴极的阳极保护法 | |
| C. | 根据分散质粒子的大小分类,将分散系分为溶液、浊液、胶体 | |
| D. | 为防止月饼等富脂等食品被氧化,常在包装中放入还原铁粉等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液中滴加稀硫酸:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为9的氧原子符号为16O | |
| B. | 某元素的一种原子质量数为X则该元素的相对原子质量为X | |
| C. | H、D、T三种核素化学性质不相同 | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com