
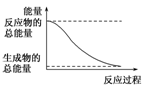
下列变化为放热反应的是
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g) H2(g)+I2(g) ΔH=+14.9 kJ/mol
H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
对于ⅣA族元素,下列叙述中正确的是( )
A.SiO2和CO2都是由极性共价键形成的非极性分子
B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8
C.该族元素+4价的氧化物都比+2价的氧化物稳定
D.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。





试回答:
(1)若X是强氧化性单质,则A不可能是 de 。
a.S b.N2
c.Na d.Mg
e.Al
(2)若X是金属单质,C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) 2Fe3++Fe 3Fe2+,防止Fe2+被氧化 。
(3)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则X的化学式可能为(写出不同类物质) NaOH(或KOH) 或 HCl(或其他强酸) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
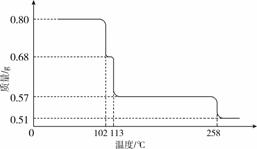
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________________________________________;
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为 CuSO4 CuO+SO3↑ 。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为 CuSO4·5H2O ,其存在的最高温度是 102 ℃ ;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为 Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑ ;
(4)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= 2.2×10-8 mol·L-1{Ksp[Cu(OH)2]=2.2×10-20}。若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是 0.2 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属材料在日常生活和生产中被广泛运用。下列说法中正确的是( )
A.钠、铝、铜在空气中氧化均生成碱性氧化物
B.试管壁上的铜、银均可用稀硝酸洗涤除去
C.用Na、Fe、Cu分别在Cl2中燃烧可制备NaCl、FeCl2、CuCl2
D.电解含Fe3+、Cu2+、Ag+的混合溶液在阴极上依次析出Ag、Fe、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0,
2XY(g) ΔH<0,
达到甲平衡时,再改变某一条件后,达到乙平衡,对此过程的分析正确的是
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况

查看答案和解析>>
科目:高中化学 来源: 题型:
相对分子质量为128的有机物A完全燃烧只生成CO2和H2O,若A含一个六元碳环且可与NaHCO3溶液反应,则环上一氯代物的数目为( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列微粒的电子式。
C2H4 CH3— OH–
(2)键线式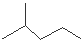 表示的分子式 ;结构简式为 ;名称是 。
表示的分子式 ;结构简式为 ;名称是 。
(3)、根据命名写出该物质的结构简式
2,3-二甲基-2-戊烯 ; 对二甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com