
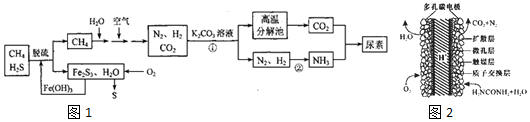
分析 以天然气(含H2S)为原料,加入氢氧化铁脱硫得到甲烷和Fe2S3,通入氧气发生反应生成氢氧化铁和硫单质,氢氧化铁循环使用,甲烷和空气水混合反应得到氮气、二氧化碳和氢气,通入碳酸钾溶液发生反应得到碳酸氢钾,高温分解生成二氧化碳,氮气和氢气一定条件下反应生成氨气,二氧化碳和氨气反应得到尿素.
(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动;可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度、百分含量不再变化;该反应是气体体积缩小的反应,反应过程中压强会发生变化,据此进行判断;
(4)H2NCOONH4在水溶液中发生水解反应,生成两种弱电解质一水合氨和氨基甲酸;
(5)由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算;
(6)尿素燃料电池中尿素在负极上失去电子生成氮气、二氧化碳.
解答 解:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-,
故答案为:CO32-+CO2+H2O═2HCO3-;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S,
故答案为:2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小,N2+3H2?2NH3 △H<0,反应是气体体积减小的放热反应,
A.反应速率之比等于化学方程式计量数之比,单位时间内生成nmol N2同时消耗3nmol H2,说明正逆反应速率相同,反应达到平衡状态,故A正确;
B.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量发生变化,气体质量不变混合气体的平均摩尔质量不变 说明反应达到平衡状态,故C正确;
D.N2、H2、NH3浓度之比为1:3:2不能说明反应达到平衡状态,故D错误;
故答案为:减小,AC;
(4)H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中发生水解反应生成氨基甲酸和一水合氨,反应的离子方程式为H2NCOO-+NH4++H2O?H2NCOOH+NH3.H2O,
故答案为:H2NCOO-+NH4++H2O?H2NCOOH+NH3.H2O;
(5)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为$\frac{120×1{0}^{6}g}{60g/mol}$×22.4L/mol×10-3m3=4.48×104m3,
故答案为:4.48×104;
(6)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,
故答案为:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
点评 本题以尿素的合成为信息考查化学用语及化学平衡、电化学等知识,侧重考查学生知识综合运用能力,题目难度中等,(4)为学生解答的易错点,注意氨基甲酸和一水合氨都为弱电解质,(5)注意守恒思想的应用.


科目:高中化学 来源: 题型:选择题
| A. | 可加入酸性KMnO4溶液鉴别苯、乙醇和四氯化碳 | |
| B. | 碳酸钠溶液、蛋白质溶液均具有丁达尔效应 | |
| C. | 煤的干馏、石油的分馏、油脂的水解都是化学变化 | |
| D. | 蔗糖与稀硫酸溶液共热后加入银氨溶液,再水浴加热产生银镜,证明蔗糖水解产物中有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 AlC13溶液中:K+、Na+、HCO3-、SO42- | |
| B. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、Cl- | |
| C. | 能使pH试纸显深红色的溶液:Fe3+、Cl-、Ba2+、I-、SCN- | |
| D. | $\frac{{K}_{W}}{c(O{H}^{-})}$=10-12mol•L-1的无色溶液中:Na+、CO32-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++OH-═H2O CH3COOH+NaOH═CH3COONa+H2O | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | CO32-+2H+═CO2↑+H2O CaCO3+2HCl═CaCl2+CO2↑+H2O | |
| D. | Al(OH)3+OH-═AlO2-+2H2O Al(OH)3+NaOH═NaAlO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 g H2含有的氢原子数目为2NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 L 1 mol•L-1 KOH溶液中含有的钾离子数目为NA | |
| D. | 1 mol Zn变为Zn2+失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Na2CO3;H2SO4+K2CO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+(NH4)2SO4 | D. | KOH+CH3COONH4;Ba(OH)2+NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
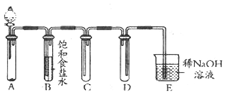 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使石蕊试液变红的溶液中:Na+、K+、Br-、SO42- | |
| B. | 氯化亚铁溶液中:K+、Al3+、SO42-、MnO4- | |
| C. | 硫酸铝溶液中:K+、AlO2-、Na+、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NH4+、Na+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com