
| A. | CH3CH=CH2 烯烃  | B. | 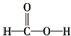 醛类-CHO 醛类-CHO | C. | 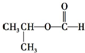 羧酸-COOH 羧酸-COOH | D. |  酚类-OH 酚类-OH |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到了稳定结构.
H2O和CS2分子中的原子都达到了稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
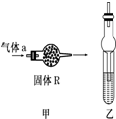 干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:
干燥管在不同情况下常具有多种功能.下列两种不同图示就分别代表了干燥管的不同应用.请回答有关问题:| A | B | C | D | |
| 气体a | NH3 | SO2 | C2H4 | Cl2 |
| 固体R | 碱石灰 | 浓硫酸 | 高锰酸钾 | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
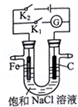
| A. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| B. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(SO42-)为0.1mol/L | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | K+可能存在 | D. | Ba2+一定不存在,Ca2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
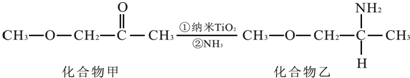
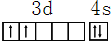 ,其原子核外共有22种运动状态不相同的电子.
,其原子核外共有22种运动状态不相同的电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com