
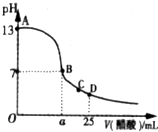
 在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示.
在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示.分析 (1)未加醋酸时,NaOH溶液的pH=13,则该溶液中c(OH-)=0.1mol/L,NaOH是强电解质,则NaOH溶液中c(NaOH)=c(OH-);
(2)NaOH是强电解质、醋酸是弱电解质,醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使NaOH、醋酸混合溶液呈中性,则醋酸应该稍微过量;
(3)D点溶液中溶质为等物质的量浓度的醋酸和醋酸钠,根据图知,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,结合物料守恒判断.
解答 解:(1)未加醋酸时,NaOH溶液的pH=13,则该溶液中c(OH-)=0.1mol/L,NaOH是强电解质,则NaOH溶液中c(NaOH)=c(OH-)=0.1mol/L,故答案为:0.1mol/L;
(2)NaOH是强电解质、醋酸是弱电解质,醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使NaOH、醋酸混合溶液呈中性,则醋酸应该稍微过量,醋酸浓度是NaOH浓度的2倍,则醋酸体积应该是NaOH体积的一半多,则a>12.5,故答案为:>;
(3)D点溶液中溶质为等物质的量浓度的醋酸和醋酸钠,根据图知,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,结合物料守恒得c(CH3COO-)>c(Na+),醋酸电离程度较小,则c(Na+)>c(H+),
所以离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析及计算能力,明确图中每点溶液中溶质成分及其性质、溶液酸碱性是解本题关键,知道溶液中存在的电荷守恒和物料守恒,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36 L | B. | 6.72 L | ||
| C. | 大于3.36 L,小于5.60 L | D. | 大于5.60 L,小于6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
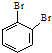 和
和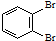
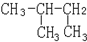 和
和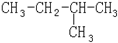
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③⑤⑧ | C. | ②③④⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等,以减小实验误差 | |
| B. | NaHSO4固体受热变为熔融状态(未发生化学反应),需要克服的作用力有:离子键和共价键 | |
| C. | 在Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深 | |
| D. | 用蒸馏的方法分离淀粉溶液与Cu(OH)2悬浊液的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | CH2=CH2+Br2→CH2BrCH2Br | ||
| C. | 2C2H5OH+2Na→2C2H5ONa+H2↑ | D. | 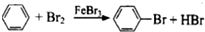 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
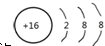 ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com