��2009?���ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ������£�
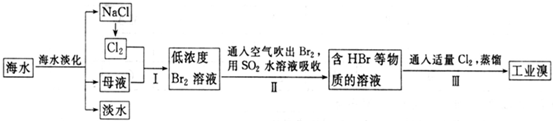
��1�����оٺ�ˮ������һ�ַ�����
�����������������ӽ��������е�һ��
�����������������ӽ��������е�һ��
��
��2����NaCl��Һ��⣬�ڵ����п�ֱ�ӵõ��IJ�ƷH
2��
Cl2
Cl2
��
NaOH
NaOH
����H
2��
NaClO
NaClO
��
��3����������ѻ��Br
2����������ֽ�Br
2��ԭΪBr
-����Ŀ��Ϊ
������Ԫ��
������Ԫ��
��
��4���������SO
2ˮ��Һ����Br
2�������ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ
SO2+Br2+2H2O�T4H++2Br-+SO42-
SO2+Br2+2H2O�T4H++2Br-+SO42-
���ɴ˷�Ӧ��֪�������������⣬�ڹ�ҵ������Ӧ�������Ҫ������
ǿ����豸�����ظ�ʴ
ǿ����豸�����ظ�ʴ
��
��5��ij��ѧ�о���ѧϰС��Ϊ�˽�ӹ�ҵ�����ᴿ��ķ������������й����ϣ�Br
2�ķе�Ϊ59�森����ˮ���ж��Ժ�ǿ��ʴ�ԣ����Dzι��������̺��˽����װ�ã�

�������������ۣ�
��ͼ������B�����ƣ�
������
������
��
������ʵ��װ�����������Ӿ��������������ܣ���ԭ����
Br2��ʴ��
Br2��ʴ��
��
��ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ�������
�����¶ȼ�b���¶ȣ����ռ�59��ʱ�����
�����¶ȼ�b���¶ȣ����ռ�59��ʱ�����
��
��C��Һ�������ɫΪ
�����ɫ
�����ɫ
��Ϊ��ȥ�ò������Բ���������Cl
2���������м���NaBr��Һ����ַ�Ӧ���ٽ��еķ��������
����
����
��






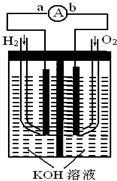 ��2009?�������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã�
��2009?�������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�ã�