
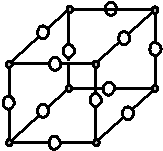
 现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1.分析 常温下X元素单质的密度在自然界中最小,是H,Y是短周期元素中未成对电子数与原子序数之比最大的原子,是N元素;Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等是1s22s22p4或1s22s22p63s2,但Y与Z可形成多种气态化合物,因此是O元素;W的基态原子的内层轨道全部排满电子,且最外层电子数为1,是Cu,据此进行答题.
解答 解:常温下X元素单质的密度在自然界中最小,是H,Y是短周期元素中未成对电子数与原子序数之比最大的原子,是N,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等是1s22s22p4或1s22s22p63s2,但Y与Z可形成多种气态化合物,因此是O,W的基态原子的内层轨道全部排满电子,且最外层电子数为1,是Cu,
(1)根据晶胞结构,利用均摊法可知N:8×$\frac{1}{8}$=1,Cu:12×$\frac{1}{4}$=3,
故答案为:3;
(2)N原子的2p能级处于半充满状态,而原子处于半充满、全充满、全空是稳定结构,因此第一电离能N>O,
故答案为:N;
(3)①与N2O互为等电子体的分子的化学式为CO2,
故答案为:CO2;
②互为等电子体的物质的结构相似,因此②N2O的空间构型为直线形
故答案为:直线形;
(4)Cu(NH3)4Cl2分子中的1个NH3含4个σ键,4个NH3含12个σ键,4个NH3与Cu2+形成4个配位键,因此共含16个σ键,所以1mol该配合物中含有σ键的数目为16NA或16×6.02×1023个,
故答案为:16NA或16×6.02×1023.
点评 本题考查结构性质位置关系应用,题目难度中等,试题涉及晶胞结构、氢键、分子结构与性质、杂化轨道、等电子体、化学键等知识,正确推断各元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系.


科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,则a>b | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 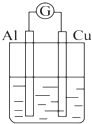 NaOH溶液 | B. | 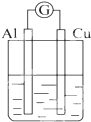 稀硫酸 | C. | 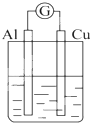 稀硝酸 | D. |  稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3- -CH3 -CH3 | C. | HCOOH | D. | CH3OCOOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3mol H2充分反应,生成物中的 N-H键的数目为6NA | |
| B. | 23g NO2和 N2O4的混合物中原子总数为1.5NA | |
| C. | 1L 0.1mol•L-1的Na2S溶液中S2- 与 HS- 的总数为0.1NA | |
| D. | 向FeI2溶液中通入适量的氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和乙醇的混合液(3:1)加热至140℃ | |
| B. | 浓硫酸和苯的混和液加热至80℃ | |
| C. | 煮沸氯乙烷和苛性钾溶液 | |
| D. | 煮沸氯乙烷和苛性钾的醇溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com