
| A. | 碱性氧化物均属于金属氧化物 | |
| B. | 根据电解质在水溶液中的导电性强弱,将电解质分为强电解质和弱电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 稀豆浆、雾、FeCl3溶液均为胶体 |
分析 A.能跟酸起反应,生成盐和水的氧化物叫碱性氧化物;
B.根据电解质在水溶液中能否完全电离,将电解质分为强电解质和弱电解质;
C.分散系的分类依据是分散质微粒直径大小;
D.FeCl3溶液是溶液.
解答 解:A.能跟酸起反应,生成盐和水的氧化物叫碱性氧化物,碱性氧化物均为金属氧化物,故A正确;
B.根据电解质在水溶液中能否完全电离,将电解质分为强电解质和弱电解质,能完全电离的是强电解质,不能完全电离的是弱电解质,故B错误;
C.根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,故C错误;
D.稀豆浆、雾为胶体,FeCl3溶液是溶液,故D错误.
故选A.
点评 本题考查物质的分类、电解质非电解质、分散系等知识,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.1molN5+离子中所含的电子数为3.4NA | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 用溶有1molFeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有的胶粒数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
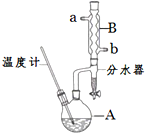 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,0.1NA个HCl分子的体积为22.4L | |
| B. | 标准状况下,22.4L氖气含有2NA个原子 | |
| C. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.6NA | |
| D. | 1mol氖气中含有的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | KMnO4 | C. | FeCl3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
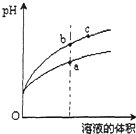 某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )
某温度下,相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示,据图判断下列说法正确的是( )| A. | b点酸的总浓度大于a点酸的总浓度 | |
| B. | c点溶液的导电性比b点强 | |
| C. | a点Kw的数值比c点溶液的Kw的数值大 | |
| D. | b点水电离产生的c(H+)比a点大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 浓度商 |
| (1) | 0.0600 | 0.400 | 2.000 | 不填 |
| (2) | 0.0960 | 0.300 | 0.500 | 不填 |
| (3) | 0.0862 | 0.263 | 1.020 | 不填 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 碳酸钡与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气和石灰乳反应:Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com