
 ��һ��������ܱ������У��������»�ѧ��Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
��һ��������ܱ������У��������»�ѧ��Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���| t�� | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
���� ��1��ƽ�ⳣ��Ϊ������ƽ��Ũ�Ȼ�ѧ�������ݳ˻��뷴Ӧ��ƽ��Ũ�Ȼ�ѧ�������ݳ˻�֮�ȣ�
��2���ɱ������ݿ�֪�������¶�ƽ�ⳣ����С��˵�������¶�ƽ�����淴Ӧ�ƶ���
��3������ijһ��Ӧ���Ũ�ȣ�ƽ�������ƶ���������Ӧ���ת��������
��4����������м���2molCO2��2molH2�����߰����ʵ���1��1��Ӧ����ƽ��ʱ������̼�����������ʵ�����ȣ������ɵ�CO���������ʵ�����ȣ���CO��g��+H2O��g��?CO2��g��+H2��g��ƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$=1����ƽ��ʱ����ֵ����ʵ�������ȣ�
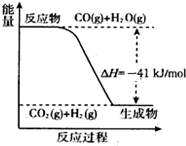
��5����ͼ��֪����CO��g��+H2O��g��?CO2��g��+H2��g����H=-41kJ/mol��
��֪����2H2��g��+O2��g���T2H2O��g����H=-484kJ/mol��
���ݸ�˹���ɣ��١�2+�ڿɵã�2CO��g��+O2��g��?2CO2��g����
��� �⣺��1��CO��g��+H2O��g��?CO2��g��+H2��g����ƽ�ⳣ������ʽK=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
�ʴ�Ϊ��$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$��
��2���ɱ������ݿ�֪�������¶�ƽ�ⳣ����С��˵�������¶�ƽ�����淴Ӧ�ƶ����������¶�ƽ�������ȷ�Ӧ���У�������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3������H2O��g����Ũ�ȣ�ƽ�������ƶ���CO��ת��������
�ʴ�Ϊ������
��4����������м���2molCO2��2molH2�����߰����ʵ���1��1��Ӧ����ƽ��ʱ������̼�����������ʵ�����ȣ������ɵ�CO���������ʵ�����ȣ���CO��g��+H2O��g��?CO2��g��+H2��g��ƽ�ⳣ��K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$=1����ƽ��ʱ����ֵ����ʵ�������ȣ���ƽ��ʱ������̼���������Ϊ$\frac{1}{4}$��100%=25%��
�ʴ�Ϊ��25%��
��5����ͼ��֪����CO��g��+H2O��g��?CO2��g��+H2��g����H=-41kJ/mol��
��֪����2H2��g��+O2��g���T2H2O��g����H=-484kJ/mol��
���ݸ�˹���ɣ��١�2+�ڿɵã�2CO��g��+O2��g��?2CO2��g����H=-566kJ/mol��
�ʴ�Ϊ��2CO��g��+O2��g��?2CO2��g����H=-566kJ/mol��
���� ���⿼�黯ѧƽ����㡢��ѧƽ��Ӱ�����ء�ƽ�ⳣ�����Ȼ�ѧ����ʽ��д�ȣ���4����ע����ݷ���ʽ�л�ѧ������֮��Ϊ1��l��1��1��ƽ�ⳣ��K=1�������Խ��з�������Ѷ��еȣ�


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ijѧϰС���������кϳ�·�ߺϳ�1-������CH3CH=CH2+CO+H2$\stackrel{һ������}{��}$CH3CH2CH2CHO$��_{N/��}^{H_{2}}$CH3CH2CH2CH2OH
ijѧϰС���������кϳ�·�ߺϳ�1-������CH3CH=CH2+CO+H2$\stackrel{һ������}{��}$CH3CH2CH2CHO$��_{N/��}^{H_{2}}$CH3CH2CH2CH2OH�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1s��2px��2py��2pz�����������Գ��� | |
| B�� | ��Ϊp����ǡ�8�����εģ�����p����Ҳ�ǡ�8������ | |
| C�� | ��ԭ����ֻ��һ�����ӣ�����ԭ��ֻ��һ����� | |
| D�� | ԭ�ӹ��ʾ��ͼ�������ͼ���������������������˶�״̬��ͼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�����Һ�п��ܺ��е����������ʾ��
ij�����Һ�п��ܺ��е����������ʾ��| ���ܴ������е������� | H+��Ag+��Mg2+��Al3+��NH4+��Fe3+ |
| ���ܴ������е������� | Cl-��Br-��I-��CO32-��AlO2- |
| Cl2���������״���� | 5.6L | 11.2L | 22.4L |
| n ��Cl-�� | 2.5mol | 3.0mol | 4.0mol |
| n ��Br-�� | 3.0mol | 2.6mol | 1.6mol |
| n ��I-�� | x mol | 0 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com