
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠与硫酸铜溶液反应,可置换出铜 ③过氧化钠与水反应时可放出氧气 ④氯气与铁反应生成三氯化铁 ⑤钠、氢气都能在氯气中燃烧生成白雾 ⑥久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.③④ B.①③⑤
C.②④ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是 .
(2)反应Ⅰ完成后,铁元素的存在形式为 .(填离子符号)请写出生成该离子的离子方程式 .
(3)x、y对应的数值范围分别是 、 .
(4)下列关于NaClO调pH的说法正确的是 .
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO﹣+H+═HClO,ClO﹣消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO﹣+H2O═HClO+OH﹣,OH﹣消耗H+,从而达到调节pH的目的
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
应用所学知识回答下列问题:
(1)下列物质对蛋白质的化学性质具有明显影响的是(写代号)________。
A.重晶石 B.蓝矾 C.碘酒 D.高锰酸钾
E.酒精 F.生牛奶 G.熟鸡蛋
(2)如果你发现有人误服重金属盐而出现了轻微中毒症,需要你马上对病人进行抢救,你认为上述物质中可以应用的是(写代号) ________。
(3)当你选择物质对病人进行抢救以后,下一步的打算或做法是(写代号) ________。
A.建议病人快去医院继续治疗
B.将病人安置于通风处呼吸新鲜的空气
C.建议病人卧床休息
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋资源的综合运用,是科学研究的重要课题。某化学兴趣小组,欲对海水进行研究。同学们提出了下列问题。请回答下列问题。
(1)导致海水有咸味的物质是________(写化学式),它的最大用途是________________。
(2)从海水中提取NaCl,采用的方法是____________。
(3)提取NaCl后剩余的海水(苦卤)可用来提取Mg和Br2。请你设计提取Mg和Br2的工业流程。
① ________________________________________
________________________________________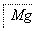
② ________________________________________
________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.天然纤维就是纤维素
B.合成纤维的主要原料是天然气、石油化工产品、煤化工产品
C.化学纤维的原料不可以是天然纤维
D.生产合成纤维的过程中发生的是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g B.500 mL,117 g C.1 000 mL,117 g D.任意规格,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1)第①步Cu与混酸反应的离子方程式为 .得到滤渣1的主要成分为 .
(2)第②步中加入H2O2的作用是 ,使用H2O2的优点是 ;调溶液pH的目的是 .
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是 .
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案:
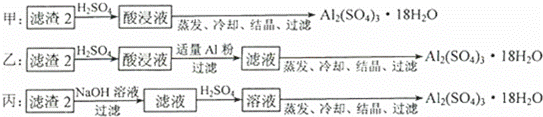
上述三种方案中, 方案不可行,原因是 ;从原子利用率角度考虑, 方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
c mol/L EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:
Cu2++H2Y2﹣→CuY2﹣+2H+.写出计算CuSO4•5H2O质量分数的表达式ω= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com