

| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
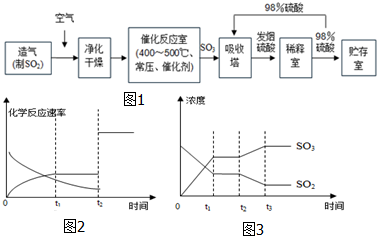
分析 (1)硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂;
(2)沸腾炉中硫铁矿与氧气在高温下反应生成三氧化二铁和二氧化硫,二氧化硫在接触室中被氧化成三氧化硫;
(3)根据工业上接触法制硫酸的原料、过程,制硫酸原料为硫铁矿,进样前首先将硫铁矿粉碎,增大接触面积;生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,在接触室中的催化剂可以加快反应的速率,但不会影响平衡的移动,二氧化硫的转化率不会改变;在吸收塔中生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全等来解题;
(4)根据可逆2SO2+O2$?_{加热}^{催化剂}$2SO3进行分析,增大压强,平衡向气体体积缩小的方向移动,即正向移动,提高了转化率,结合表中数据分析采用常压的理由;
(5)根据反应的转化关系式计算,关系式为:FeS2~2SO2~2SO3~2H2SO4.
解答 解:(1)A.硫酸厂厂址的选择综合经济效益考虑,硫酸产品的运输成本要高于原料黄铁矿的运输成本,故A错误;
B.风光秀丽的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工业城市,导致原料运输与产品运输成本高,同时还会对旅游城市造成污染,故B错误;
C.由于硫酸产品的运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市,故C正确;
D、人口稠密的文化、商业中心城市,远离原料基地和消耗硫酸的工业城市,同时为了防止污染环境,不宜考虑作为硫酸厂厂址,故D错误;
故答案为:C;
(2)沸腾炉中硫铁矿与氧气在高温下反应生成三氧化二铁和二氧化硫,4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2;二氧化硫在接触室中被氧化成三氧化硫; 2SO2+O2$?_{△}^{催化剂}$ 2SO3
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2;2SO2+O2$?_{△}^{催化剂}$ 2SO3;
(3)A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中充分燃烧,硫铁矿粉碎后与氧气的接触面积增大,利于其充分的燃烧,大块的硫铁矿在空气中也能燃烧,只是燃烧不充分,会造成资源的浪费,故A错误;
B.从沸腾炉出来的炉气需净化是因为其中带有的杂质气体会让下一步接触室里面的催化剂中毒,催化剂中毒会影响反应的进度,故B错误;
C.一般来说,催化剂是指参与化学反应中间历程的,又能选择性地改变化学反应速率,而其本身的数量和化学性质在反应前后基本保持不变的物质.通常把催化剂可以加速化学反应,使反应尽快达到平衡状态,但不影响化学平衡,故二氧化硫的转化率不会改变,只是达到平衡的时间减短了,故C错误;
D.生成的三氧化硫与水反应生成硫酸,若直接用水吸收会形成酸雾,因此在生产实践中采用98.3%的浓硫酸吸收,这样可以防止形成酸雾,使三氧化硫吸收完全,故D正确;
故答案为:D;
(4)根据可逆2SO2+O2$?_{加热}^{催化剂}$2SO3进行分析,增大压强,平衡向气体体积缩小的方向移动,即正向移动,提高了转化率,结合表中数据可知:常压下转化率已经很高,增加压强可提高转化率,但增加了设备、动力成本等,效益反而下降;
故答案为:升高;常压下转化率已经很高,增加压强可提高转化率,但增加了设备、动力成本等,效益反而下降;
(5)根据S元素守恒可知:FeS2~~~~~~~~~~~~~2H2SO4
120t 2×98t
500t×0.48×(1-2%)×0.96 m×0.98
列比例式:$\frac{120t}{500t×0.48×0.98×0.96}$=$\frac{2×98t}{m×0.98}$
解得m=376.32t;
故答案为:376.32t.
点评 本题考查了工业上接触法制硫酸的原料、过程,明确发生的化学反应及设备、原料、在生产实践中采用98.3%的浓硫酸吸收的原因,并注意理论与实际生产中的差别来解答,还考查了有关计算以及外界条件对反应速率和平衡状态的影响等,难度适中.


科目:高中化学 来源: 题型:选择题
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:A<C | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | B的最高价氧化物对应的水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 如果反应开始时加入2molN2和6molH2,则达到平衡时,n(N2):n(H2)=1:3 | |
| C. | 达到化学反应限度时,生成2mol NH3 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
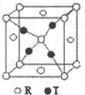 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题: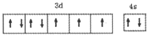 .
.| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com