
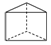
 ,该结构的二氯代物有3种.
,该结构的二氯代物有3种. 分析 根据等效氢,有1种氢原子,二氯代物的同分异构体可以采用固定一个氯原子的方法来寻找,即先进行一氯代物,产物有一种,再在一氯代物的基础用一个氯原子代替一个氢原子可得二氯代物,两个氯原子的位置只有三种情况:一是都位于正方形面的边上(连接两个三角形面的边),二是正方形面的对角线上,三是三角形面的边上.
解答 解:根据等效氢,该结构有1种氢原子,先进行一氯代物,产物有一种,再在一氯代物的基础用一个氯原子代替一个氢原子可得二氯代物,两个氯原子的位置只有三种情况:一是都位于正方形面的边上(连接两个三角形面的边),二是正方形面的对角线上,三是三角形面的边上,所以二氯代物有3种同分异构体.
故答案为:3.
点评 本题考查有机物的结构和同分异构体的判断,侧重于苯的结构与性质的考查,知识综合性较大,难度中等,要求学生具有整合知识的能力、对知识进行迁移运用.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
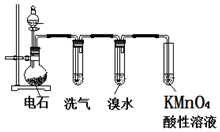 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: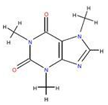 ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: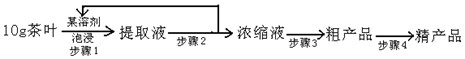
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率:4v正(O2)=5v逆(NO) | |
| B. | NH3、O2、NO、H2O的分子个数比是4:5:4:6 | |
| C. | 单位时间内生成4 mol NO的同时消耗6 mol H2O | |
| D. | 反应混合物中NH3的体积分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com