
| A. | 两溶液中c(OH-):①=② | |
| B. | 两溶液的物质的量浓度:①=② | |
| C. | 两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的两溶液分别与同浓度的盐酸完全中和,消耗盐酸的体积:①>② |
分析 A、pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等;
B、一水合氨是弱电解质,不能完全电离,氢氧化钠是强电解质,完全电离;
C、pH相等的强碱和弱碱加水稀释,强碱溶液pH变化大;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多.
解答 解:A、pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等,故A正确;
B、一水合氨是弱电解质,不能完全电离,pH=12的氨水中,其物质的量浓度大于0.01mol/L,故B错误;
C、pH相等的氨水和氢氧化钠溶液加水稀释时,pH都减小,但是NaOH溶液pH减小的快,所以稀释后溶液的pH:①>②,故C正确;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多,与盐酸中和时消耗的盐酸①>②,故D正确;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质的电离平衡及其影响因素为解答关键,掌握掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
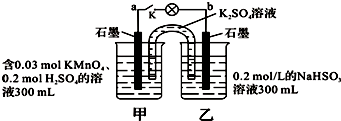
| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1 mol•L-1 | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,外电路的电子方向是从a到b | |
| D. | 乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 器材和试剂 | 相应实验 |
| A | 洗气瓶,饱和Na2CO3溶液、浓硫酸、含HCl和水蒸气的CO2气体 | 除去CO2中的HCl和水蒸气 |
| B | 分液漏斗、烧杯、蒸馏水、溴和苯的混合物 | 分离溴和苯的混合物 |
| C | 铁架台、试管、带导管的单孔塞、浓硫酸、铜片 | 实验室制取SO2 |
| D | 铁架台、试管、带导管的单孔塞、棉花、酒精灯、氯化铵晶体、熟石灰 | 实验室制取NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ④ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 1.00 mol NaCl中含有6.02×1023个NaCl分子 | |
| D. | 纯净矿泉水、铝热剂、漂白粉均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com