
【题目】如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验.试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色).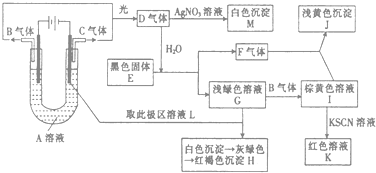
(1)A的化学式为 , E的名称为 .
(2)I和F反应的离子方程式是 .
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是 , 阳极的电极反应式为 , 阴极的电极反应式为 , 电解的化学方程式为 .
【答案】
(1)KCl;硫化亚铁
(2)2Fe3++H2S=2Fe2++S↓+2H+
(3)产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O ![]() Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
【解析】解:电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H 是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.(1)通过以上分析知,A为KCl;E是硫化亚铁.所以答案是:KCl;硫化亚铁;(2)通过以上分析知,I是氯化铁溶液,F是硫化氢,氯化铁有氧化性,硫化氢有还原性,所以氯化铁和硫化氢能发生氧化还原反应生成氯化亚铁和硫单质、盐酸,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+ . 所以答案是:2Fe3++H2S=2Fe2++S↓+2H+;(3)若将电解装置中的阳极换成铁棒,此时阳极是活泼电极,发生金属铁失电子的氧化反应,即Fe﹣2e﹣═Fe2+ , 阴极上是氢离子得电子的还原反应,即2H++2e﹣═H2↑,溶液的碱性增强,会和亚铁离子结合产生白色沉淀氢氧化亚铁,则在U型管底部可观察到产生了白色絮状沉淀,总反应为:Fe+2H2O ![]() Fe(OH)2↓+H2↑,所以答案是:产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O
Fe(OH)2↓+H2↑,所以答案是:产生了白色絮状沉淀;Fe﹣2e﹣═Fe2+;2H++2e﹣═H2↑;Fe+2H2O ![]() Fe(OH)2↓+H2↑.
Fe(OH)2↓+H2↑.


科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混有的少量杂质(括号内物质为杂质),错误的是( )
A.苯(苯酚):氢氧化钠溶液,充分震荡静止后,分液
B.乙醇(水):加入新制生石灰,蒸馏
C.溴苯(溴):加入氢氧化钠溶液,充分震荡静止后,分液
D.乙酸(乙醇):加入金属钠,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 
A.图甲表示反应:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2 , K1>K2
B.图乙表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,乙的压强比甲的压强大
C.图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.1molL﹣1 KHC2O4溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HC2O ![]() )+c(OH﹣)+c(C2O
)+c(OH﹣)+c(C2O ![]() )
)
B.c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )=0.1 mol?L﹣1
)=0.1 mol?L﹣1
C.c(C2O ![]() )<c(H2C2O4)
)<c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是__________________________________.
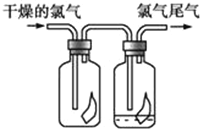
(2)写出C12与水反应的化学方程式________________________
(3)为防止氯气污染空气,可用氢氧化钠溶液吸收多余的氯气,原理是________________(用化学方程式表示).根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________(填化学式,下同)。
(4)氯气泄漏时,人们需尽快远离现场,可用浸有一定浓度某物质水溶液的毛巾捂住口鼻,最适宜采用的物质是__________.
A.NaOH B.NaCl C.KBr D.Na2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
化学反应 | 平衡常温 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)反应②是(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示.则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”“<”或“=”). 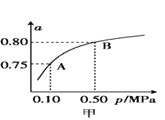
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”“=”或“<”).
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)﹣t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是
当曲线Ⅰ变为曲线Ⅲ时,改变的条是 . 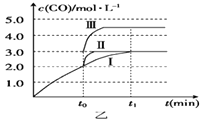
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Ba2+、OH﹣、NO3﹣、Na+
B.NH4+、OH﹣、SO42﹣、K+
C.Ca2+、H+、Cl﹣、CO32﹣
D.Cu2+、SO42﹣、Ba2+、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com