
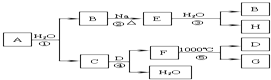
 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )| A. | 反应①、③中H2O均是还原剂 | |
| B. | D与H溶液反应后所得溶液的溶质成分有三种可能 | |
| C. | 工业上常用C的悬浊液与Cl2反应制取漂白粉 | |
| D. | 电解F与盐酸反应后的溶液以制取单质A |
分析 在自然界存在最广泛的ⅡA族元素中常温下与水反应的是单质Ca,与水反应生成Ca(OH)2和H2,则B是H2,C是Ca(OH)2,E是NaH,H是NaOH,CaCO3受热分解生成CO2和CaO,而CO2恰好与Ca(OH)2反应生成CaCO3和H2O,所以D和G分别是CO2和CaO,以此解答该题.
解答 解:在自然界存在最广泛的ⅡA族元素中常温下与水反应的是单质Ca,与水反应生成Ca(OH)2和H2,则B是H2,C是Ca(OH)2,E是NaH,H是NaOH,CaCO3受热分解生成CO2和CaO,而CO2恰好与Ca(OH)2反应生成CaCO3和H2O,所以D和G分别是CO2和CaO,
A.反应①为Ca+2H2O═Ca(OH)2+H2↑,H2O是氧化剂,反应③为NaH+H2O═NaOH+H2↑,H2O是氧化剂,故A错误;
B.CO2对应的碳酸是二元酸,与NaOH反应时可能会生成两种碳酸盐:Na2CO3和NaHCO3,所得溶液的溶质成分有二种可能,故B错误;
C.C是Ca(OH)2,工业常用Ca(OH)2的悬浊液与Cl2反应制取漂白粉,故C正确;
D.Ca作为活泼的金属元素一般只能通过电解法来制备,可用电解熔融的CaCl2的方法制备,但不能用氯化钙溶液制备,因钙为活泼金属,可与水反应,故D错误.
故选C.
点评 本题主要考查常见金属单质及其化合物之间的相互转化,注意框图推断题的突破口,熟悉元素化合物的性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: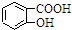 +CO32-→ +CO32-→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
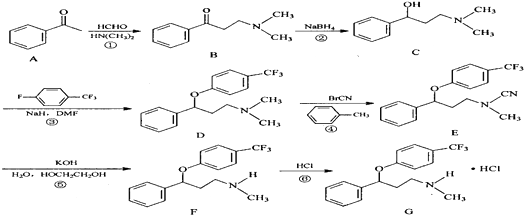
 .
.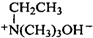 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成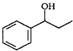 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com