
【题目】常温下,用0.l0mol/LKOH溶液滴定10.00mL 0.10mol/LH2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
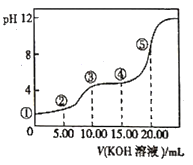
A. 点①所示溶液中![]() =1012
=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.10mol/L
【答案】D
【解析】
A.0.10mol/L H2C2O4(二元弱酸)不能完全电离,点①pH≠1;
B.点②为混合溶液,由电荷守恒分析;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解;
D.由物料守恒分析。
A.0.10mol/L H2C2O4(二元弱酸)不能完全电离,点①pH≠1,则![]() ≠1012,A错误;
≠1012,A错误;
B.点②为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),B错误;
C.点③溶液显酸性,等体积等浓度反应生成KHC2O4,HC2O4-在溶液中的电离沉淀大于其水解程度,所以c(C2O42-)>c(H2C2O4);HC2O4-在溶液中电离、水解都会消耗,使其浓度降低,所以c(K+)>c(HC2O4-),盐电离产生的离子浓度大于其反应产生的离子浓度,故c(HC2O4-)> c(C2O42-),因此溶液中离子浓度大小关系为:c(K+)>c(HC2O4-)> c(C2O42-)>c(H2C2O4),C错误;
D.点④所示溶液为K2C2O4:KHC2O4按1:1混合得到的混合溶液,由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10mol/L, D正确;
故合理选项是D


科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5 mol L-1H2SO4溶液、2 mol L-1 H2SO4溶液。甲同学研究的实验报告如下表∶
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol L-1 的硫酸溶液于三支试管中 | 反应速率∶ 镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1) 甲同学表中实验步骤②为______________________。
(2) 甲同学的实验目的是__________________________。
要得出正确的实验结论,还需要控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行实验∶

(3)乙同学在实验中应该测定的数据是_________________。
(4)乙同学完成该实验应选用的实验药品是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A. Na2CO3+2HCl= 2NaCl+H2O+CO2↑B. CO2+Ca(OH)2=CaCO3↓+H2O
C. CuSO4+ BaOH=CuOH↓+BaSO4D. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
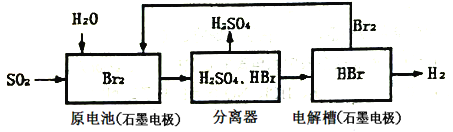
下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com