
 .
.分析 (1)旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算;NaCN为离子化合物,由Na+和CN-构成,电子式为:Na+ ;
;
(2)氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,据此书写反应的离子方程式;氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-;
(3)NaCN是强碱弱酸盐水解溶液呈强碱性,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(CN-)>c(OH-)>c(H+);向等体积pH=10的NaOH溶液和NaCN溶液溶液中氢氧根离子浓度相等,在加盐酸的过程中NaCN继续水解产生氢氧根离子会消耗更多的盐酸;
(4)元素Z与Na处于同一周期,在本周期主族元素形成的简单离子中,Z的离子半径最小,Z为铝元素,处于元素周期表中第三周期ⅢA族;比较Al和Mg金属性强弱的方法中,
a.金属性强弱与两种元素单质的硬度和熔、沸点无关;
b.测等浓度相应氯化物水溶液的pH,pH越小金属性越弱;
c.金属性越强,单质与同浓度盐酸反应的剧烈程度就越大;
d.金属性强弱与化合价高低无关(即与失去电子数多少),与难易程度有关.
解答 解:(1)已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
反应热=反应物的总键能-生成物的总键能,故△H=xkJ/mol+3×436kJ/mol-2×3×391=-92kJ/mol,解得:x=946kJ/mol,NaCN为离子化合物,由Na+和CN-构成,电子式为:Na+ ;故答案为:946kJ/mol;Na+
;故答案为:946kJ/mol;Na+ ;
;
(2)氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,反应的离子方程式为:CN-+H2O2+H2O═NH3↑+HCO3-,氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为血红色,即反应生成SCN-、SO32-,离子反应为S2O32-+CN-═SCN-+SO32-,
故答案为:CN-+H2O2+H2O═NH3↑+HCO3-;S2O32-+CN-═SCN-+SO32-;
(3)NaCN是强碱弱酸盐水解溶液呈强碱性,则溶液中各离子浓度由大到小的顺序为c(Na+)>c(CN-)>c(OH-)>c(H+);向等体积pH=10的NaOH溶液和NaCN溶液溶液中氢氧根离子浓度相等,即CN-水解产生的OH-和NaOH完全电离产生的OH-相等,但水解的程度是很微弱的,随着稀盐酸的加入,NaOH中OH-离子被消耗逐渐减少,但NaCN中OH-被消耗后又不断地水解产生OH-,因此会消耗更多的盐酸,所以NaCN产生消耗的盐酸更多,故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);大于;
(4)元素Z与Na处于同一周期,在本周期主族元素形成的简单离子中,Z的离子半径最小,Z为铝元素,处于元素周期表中第三周期ⅢA族;比较Al和Mg金属性强弱的方法中,
a.金属性强弱与两种元素单质的硬度和熔、沸点无关,故a错误;
b.测等浓度相应氯化物水溶液的pH,pH越小金属性越弱,故b正确;
c.金属性越强,单质与同浓度盐酸反应的剧烈程度就越大,故c正确
d.金属性强弱与化合价高低无关(即与失去电子数多少),与难易程度有关,故d错误;
故答案为:第三周期ⅢA族;bc.
点评 本题考查化学反应热、电子式、离子方程式的书写、离子浓度大小的比较、结构性质位置关系综合应用、难度中等,推断元素是解题关键,注意理解掌握金属性强弱比较.


科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤① | B. | ②③①④⑤ | C. | ①②③④⑤ | D. | ②①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
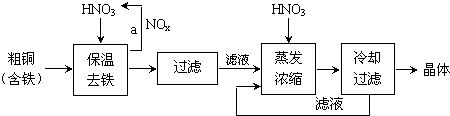
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
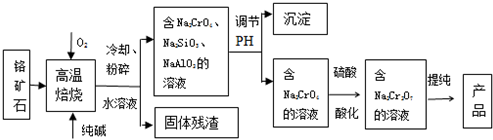
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com