
【题目】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示,下列说法正确的是
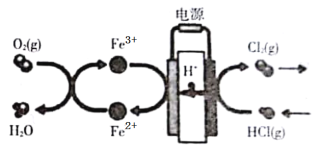
A.负极区发生的反应有Fe3++e-= Fe2+,4Fe2++O2+4H+=4Fe3++2H2O
B.Fe2+在过程中起催化剂作用
C.阳极材料可选用Ag
D.电路中转移1 mol电子时,消耗氧气5.6L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
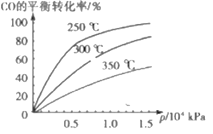
A.该反应的△H>0
B.实际生产选择的压强越高越好
C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率
D.平衡常数:K350℃<K250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知C、H2、CO的燃烧热的数据如表所示:
物质 | C | H2 | CO |
ΔH/kJ·mol-1 | -393.5 | -285.8 | -283.0 |
(1)写出C完全燃烧的热化学方程式:_____。
(2)能表示H2燃烧热的热化学方程式为____。
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为最好选择__(填写序号)。
A.H2 B.CO C.均可以
理由是___。
Ⅱ.已知下列热化学方程式:
①H2O(l)=H2(g)+![]() O2(g) ΔH=+285.8 kJ/mol
O2(g) ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
回答下列问题:
(4)上述反应中属于吸热反应的是___(填序号)。
(5)燃烧10gH2生成液态水,放出的热量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往20ml1mol/L的AlCl3溶液中滴加0.2mol/L的NaOH溶液,最后有1.17克沉淀生成,则加入NaOH溶液的体积是
A.125mLB.275mLC.325mLD.450mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
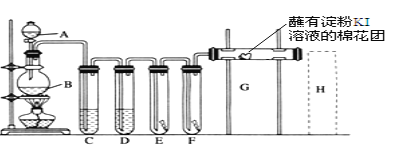
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式___________。
(2)D中放入浓H2SO4,其目的是________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是________,对比E和F中现象的差异可得出的结论及解释____________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______,反应的离子方程式是______________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成______。
(5)画出H处尾气吸收装置图并注明试剂________。
(6)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯浄Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A.C4H10的二氯代物有8种
B.甲苯与氢气充分加成后的产物的一溴代物有4种
C.分子式为C10H12O2的芳香化合物属于酯类且苯环上有四个取代基的有6种
D.分子式为C5H10并能使溴的四氯化碳溶液褪色的有机物(不含立体异构)有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入新制氢氧化铜悬浊液,能否实现实验目的_________(填”能”或”否”),若不能,其原因是_________,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol·L-1NaOH溶液分别滴定20.00ml0.1000mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COOH)>c(CH3COO-)
C.pH=7时,滴定盐酸消耗V(NaOH)大于醋酸消耗V(NaOH)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)═c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①标准状况下,含NA个氩原子的氩气体积约为22.4 L
②在Fe参与的反应中,1mol Fe失去的电子数为3NA
③标准状况下,11.2L Cl2溶于水转移的电子总数为0.5NA
④1L.1 mol/L 的Fe(OH)3胶体中含有NA个Fe(OH)3胶粒
⑤常温常压下,21g氧气和27g臭氧中含有的氧原子总数为3NA
⑥物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
A.①⑤B.①③⑥C.②③⑤D.①⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com