
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.9mol/L |
分析 X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,如果该反应向正反应方向进行,则X2、Y2浓度降低、Z浓度增大,如果该反应向逆反应方向进行,则该反应中Z浓度降低而X2、Y2浓度增大,采用极限法分析解答.
解答 解:X2、Y2、Z的起始浓度依次为0.2 mol/L、0.3mol/L、0.3mol/L,如果该反应向正反应方向进行,则X2、Y2浓度降低、Z浓度增大,如果该反应向逆反应方向进行,则该反应中Z浓度降低而X2、Y2浓度增大,
①如果该反应向正反应方向进行,且Y2完全反应,
X2(g)+2Y2(g)?Z(g)
开始(mol/L)0.2 0.3 0.3
反应(mol/L)0.15 0.3 0.15
反应末(mol/L)0.05 0 0.45
②如果该反应向逆反应方向进行,且Z完全反应,
X2(g)+2Y2(g)?Z(g)
开始(mol/L)0.2 0.3 0.3
反应(mol/L)0.3 0.6 0.3
反应末(mol/L)0.5 0.9 0
实际上该反应可能向正反应方向进行也可能向逆反应方向进行,①中X2、Y2浓度最小而Z浓度最大,②中X2、Y2浓度最大而Z浓度最小,实际上这几种物质浓度介于最大和最小之间,
即0.05<c(X2)<0.5、0<c(Y2)<0.9、0<c(Z)<0.45,
故选B.
点评 本题考查化学平衡有关计算,为高频考点,侧重考查学生分析计算能力,把握可逆反应的不完全性是解本题关键,采用极限法分析解答,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
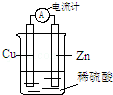
| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
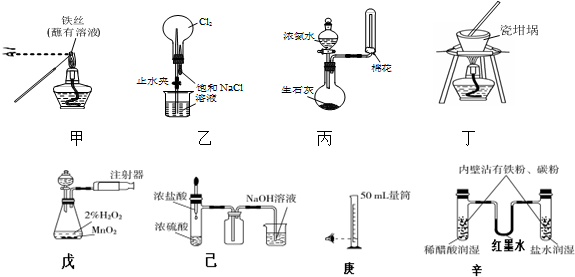
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
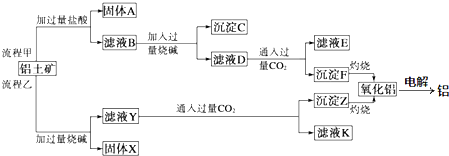
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com