
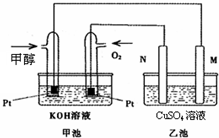
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���ˮ�����������Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪ͼ�׳�Ϊ�״�ȼ
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���ˮ�����������Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪ͼ�׳�Ϊ�״�ȼ���� ��1��ȼ�ϵ�ص������������������õ��ӵĻ�ԭ��Ӧ����������ȼ��ʧ���ӵĻ�ԭ��Ӧ�������У��͵�Դ���������������������ü��Ϸ���������Ӧ���͵�Դ�ĸ������������������ü��Ϸ����õ��ӵĻ�ԭ��Ӧ��
��2���ҳ���M�缫�ĵ缫��Ӧ��Cu2++2e-=Cu��ȼ�ϵ�ص������Ϸ����缫��Ӧ��O2+2H2O+4e-=4OH-�����ݵ缫��Ӧʽ��ϵ����غ������㣻
��3���ҳ��з����ķ�Ӧ�ֱ��ǣ������ϣ�4OH-=O2��+2H2O+4e-��������Cu2++2e-=Cu��2H++2e-=H2�����״�ȼ�ϵ�صĸ����Ϸ�����Ӧ��CH3OH+8OH--6e-=CO32-+6H2O�����ݵ缫��Ӧʽ��ϵ����غ������㣮
��� �⣺��1��ȼ�ϵ�ص������������������õ��ӵĻ�ԭ��Ӧ�������У��͵�Դ���������������������ü��Ϸ���������Ӧ������N��������M��������M���ϵ缫��ӦΪ��Cu2++2e-=Cu���ʴ�Ϊ��Cu2++2e-=Cu��
��2���ҳ���M�缫��������ͭ6.4g�����ݵ缫��Ӧ��Cu2++2e-=Cu����������ͭ6.4g��0.1mol��ת�Ƶ��ӵ����ʵ�����0.2mol����ȼ�ϵ�ص������Ϸ����缫��Ӧ��
O2+2H2O+4e-=4OH-����ת�Ƶ��ӵ����ʵ�����0.2molʱ���������������ʵ�����0.05mol�������0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��1.12��
��3���ҳ��з����ķ�Ӧ�ֱ��ǣ������ϣ�4OH-=O2��+2H2O+4e-��������Cu2++2e-=Cu��2H++2e-=H2����100mL3.00mol•L-1��CuSO4��Һ��ͭ�������ʵ����ǣ�0.3mol��ͭ���ӵõ��ӵ���0.6mol�������缫����������ǡ�����ʱ�������״���£������Ϊnmol����2n+0.6=4n�����n=0.3����װ����ת�Ƶ��ӵ����ʵ�����1.2mol���״�ȼ�ϵ�صĸ����Ϸ�����Ӧ��CH3OH+8OH--6e-=CO32-+6H2O����ת�Ƶ�����1.2mol�����ļ״������ʵ�����0.2mol��������0.2mol��32g/mol=6.4g��
�ʴ�Ϊ��6.4��
���� �����ۺϿ���ѧ�����غ�ȼ�ϵ�صĹ���ԭ���ͼ����֪ʶ�������ۺ�֪ʶ�Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �պ�K1��ʯī�缫�������Cl2 | |
| B�� | �պ�K1�����缫�Ϸ�����ԭ��Ӧ | |
| C�� | �պ�K2����������������aΪ���� | |
| D�� | �պ�K2�������������H2��˵�����������ⸯʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �£�N2H4���ǻ��ȼ�ϣ�������ΪҺ�壬����ӵ����ģ����ͼ��ʾ��������˫��ˮ������Ӧ��N2H4+2H2O2�TN2+4H2O������˵����ȷ���ǣ�������
�£�N2H4���ǻ��ȼ�ϣ�������ΪҺ�壬����ӵ����ģ����ͼ��ʾ��������˫��ˮ������Ӧ��N2H4+2H2O2�TN2+4H2O������˵����ȷ���ǣ�������| A�� | 11.2L N2�к���������Ϊ7��6.02��1023 | |
| B�� | 3.2g N2H4�к��й��ۼ�������Ϊ6��6.02��1022 | |
| C�� | ��״���£�22.4L H2O2������ԭ������Ϊ4��6.02��1023 | |
| D�� | ������3.6g H2O����������Ӧת�Ƶ��ӵ���ĿΪ2��6.02��1022 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | V��A��=2.0mol/��L•s�� | B�� | V��B��=1.2mol/��L•s�� | C�� | V��C��=3.2mol/��L•s�� | D�� | V��D��=4.0 mol/��L•s�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��g��+Cl2��g���T2HCl��g����H=-184.8KJ/mol | |
| B�� | C2H4��g��+O2��g���T2CO2��g��+2H2O��l����H=-1411.0KJ/mol | |
| C�� | CH4��g��+$\frac{3}{2}$O2��g���TCO��g��+2H2O��l����H=-6071.3KJ/mol | |
| D�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-241.8KJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Rһ����4�����Ӳ� | |
| B�� | Rԭ�ӵ�����������һ��Ϊ6 | |
| C�� | R����̬�⻯��ȵ��Ӳ�����ͬ�������ǽ���Ԫ�ص���̬�⻯���ȶ� | |
| D�� | R��̬�⻯�ﻯѧʽΪH2R |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ������
ͬ��ͬѹ�£���ͬ���������������A�������ֱ���0.2g��3.4g,������A��Ħ������Ϊ ��A�ķ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A��NaCl��Һ�ڵ��������µ����Na-��Cl-
B������ˮ���ܵ����H+�Ļ����ﶼ����
C���Ȼ�������ˮ�ܵ��磬��Һ̬�Ȼ��ⲻ�ܵ���
D��������ǿ����Һ�������ƶ�������Ŀһ���ȵ�����������Һ�������ƶ�������Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+ | B�� | Al3+ | C�� | Fe3+ | D�� | Fe2+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com