
分析 生成的6.27g沉淀为硫酸钡和碳酸钡的混合物,向沉淀中加入过量的盐酸后得到的2.33g沉淀为硫酸钡,据此可知碳酸钡沉淀的质量,然后根据n=$\frac{m}{M}$计算出碳酸钡、硫酸钡的物质的量,再根据c=$\frac{n}{V}$计算出硫酸钠的物质的量浓度;最后根据C原子守恒及V=nVm计算出生成的标准状况下的二氧化碳的体积.
解答 解:(1)生成的6.27g沉淀为硫酸钡和碳酸钡的混合物,向沉淀中加入过量的盐酸后得到的2.33g沉淀为硫酸钡,则生成的碳酸钡的质量为:6.27g-2.33g=3.94g,
根据质量守恒可知:n(Na2CO3)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol、n(Na2SO4)=n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,
则原溶液中硫酸钠的物质的量浓度为:c(Na2SO4)=$\frac{0.01mol}{0.25L}$=0.04mol/L
答:此硫酸钠溶液的物质的量浓度为0.04mol/L;
(2)根据(1)可知,n(Na2CO3)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,根据C原子守恒可知:n(CO2)=n(Na2CO3)=0.02mol,
标准状况下0.02mol二氧化碳的体积为:22.4L/mol×0.02mol=0.448L,
答:最终产生的气体在标准状况下的体积为0.448L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
 汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0
汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +
+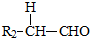 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$ (R,R’为烃基或氢)
(R,R’为烃基或氢)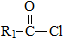 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$ +HCl (R,R’为烃基)
+HCl (R,R’为烃基) .
. 、
、 、
、 、
、 (其中之一).
(其中之一). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g N2中含有氮原子的个数为2NA | |
| B. | 在标准状况下,22.4L H2O中含有氢原子的个数为2NA | |
| C. | 1mol Fe 与盐酸反应完全反应失去的电子数为3NA | |
| D. | 1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去).
AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去). .
. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位. ;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其名称为2-甲基-1-丁烯;
,其名称为2-甲基-1-丁烯; +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com