
| A. | σ键是轴对称的,π键是镜像对称的 | |
| B. | σ键是“头碰头”式重叠,π键是“肩并肩”式重叠 | |
| C. | σ键不能断裂,π键容易断裂 | |
| D. | H原子只能形成σ键,O原子可以形成σ键和π键 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使红色石蕊试纸变蓝,也能使淀粉碘化钾试纸变蓝 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与过量锌粉反应的离子方程式为:Zn+2Fe3+═2Fe2++Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(A)=0.09mol•L-1•s-1 | B. | v(B)=0.06mol•L-1•s-1 | ||
| C. | v(C)=0.9mol•L-1•min-1 | D. | v(D)=3.6mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
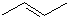 某有机物X的键线式为
某有机物X的键线式为 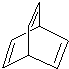
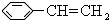 ,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程
,该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程 .
.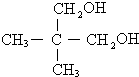 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| B. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 2.24LNH3和CH4的混合气体,所含电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
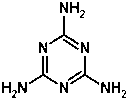 2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )
2008年9月11日,全国各地多处发现婴儿因食用三鹿奶粉而出现肾结石的事件.当晚,三鹿集团承认婴幼儿奶粉受到三聚氰胺污染,并宣布召回市面上被污染的产品.三聚氰胺的分子结构如图:有关三聚氰胺的说法正确的是( )| A. | 三聚氰胺属于芳香族化合物,但不属于芳香烃 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 三聚氰胺中的碳原子属于饱和碳原子 | |
| D. | 三聚氰胺分子中的所有原子都在一个平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液反应:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | 铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com