


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.1.4molHCl被氧化 | B.转移电子数1.806×1023 |
| C.氧化产物为0.3mol | D.还原产物为KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
制取纯净CuCl2?2H2O的生产过程是:
(1)用粗CuO(含少量铁)溶解在足量的稀盐酸里加热、过滤,得到CuCl2(含FeCl2)的溶液,经测定,溶液的PH值为3。
(2)对(1)的溶液按下列步骤进行提纯:
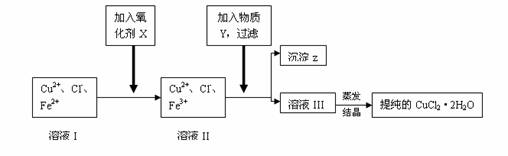
![]() 已知:①可做氧化剂的物质有(A)KMnO4 (B)K2Cr2O7 (C)H2O2 (D)NaClO
已知:①可做氧化剂的物质有(A)KMnO4 (B)K2Cr2O7 (C)H2O2 (D)NaClO
②Cu2+ 、Fe2+在PH值为4~5时不水解,而Fe3+却几乎全部水解。
试回答:
(1)加入的氧化剂X是(答编号): ;
加入X的作用是: ;
反应的离子方程式是: 。
(2)物质Y是 ;沉淀Z是 。加入Y能形成沉淀Z的原因是: 。
(3)分离出沉淀Z,并将溶液III蒸发欲获得晶体CuCl2?2H2O。采取什么措施才能顺利得到晶体CuCl2?2H2O?______________________ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州中学高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:0111 期中题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com