
25 ℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.0×10-8 |
回答下列问题。
(1)物质的量浓度为0.1 mol·L-1的下列四种物质,pH由大到小的顺序是________(填编号)。
a.Na2CO3 b.NaClO
c.CH3COONa d.NaHCO3
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列各量一定变小的是________(填编号)。
A.c(H+) B.c(CH3COO-)
C.c(H+)·c(OH-) D.
(3)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是__________________;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_________________________________________________________________。

(4)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填精确数值)。
(1)a>b>d>c
(2)AB
(3)大于 稀释相同倍数,HX的pH变化比CH3COOH大,说明HX的酸性强,故其电离平衡常数大 大于 稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱
(4)9.9×10-7 moL·L-1
【解析】(1)由电离平衡常数可知酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-,酸性越弱,其盐溶液的水解能力越强,所以pH大小顺序为a>b>d>c。
(2)醋酸是弱电解质,稀释后虽然电离程度增大,但c(CH3COO-)、c(H+)减小,c(OH-)增大,但c(H+)·c(OH-)不变, 增大。
增大。
(4)根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=(10-6-10-8)mol·L-1=9.9×10-7 mol·L-1。


科目:高中化学 来源:2014年高中化学二轮创新训练上专题9常见金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列类比关系正确的是 ( )。
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:填空题
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示
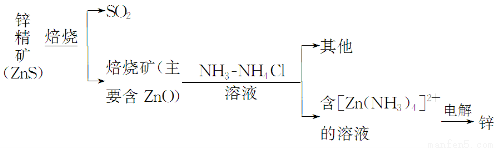
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。

查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:选择题
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是 ( )。
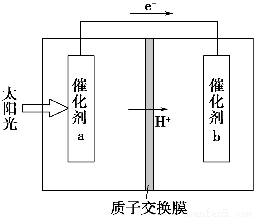
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e-=HCOOH
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:选择题
下列液体均处于25 ℃,有关叙述正确的是 ( )。
A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐
B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=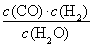 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
A.v正(H2O)=v逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗n mol H2的同时消耗n mol CO
D.容器中物质的总物质的量不随时间改变
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。
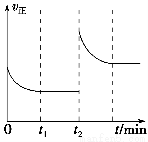
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是 ( )。
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是释放能量的反应
C.干冰气化需要吸收大量的热,这个变化是吸热反应
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
已知某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,可发生下列转化(如图所示)。其中I为五元环状化合物;J可使溴水褪色;I和J互为同分异构体;K和L都是医用高分子材料。

请回答下列问题。
(1)A的结构简式为______________。
(2)写出下列反应的反应类型:反应③属于________反应,反应④属于________反应。
(3)写出反应②和⑤的化学方程式。
②_______________________________________________________________,
⑤______________________________________________________________。
(4)写出符合下列要求的G的同分异构体______________________________。
①含有苯环;②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH反应;④只能生成两种一氯代物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com