
.(16分)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| | 开始沉淀的pH | 完全沉淀的pH |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
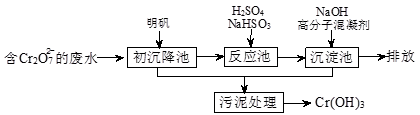
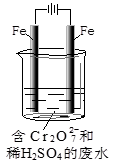
32.(16分)
(1)(8分)①Al3++3H2O Al(OH)3+3H+(2分,化学式、系数各1分)
Al(OH)3+3H+(2分,化学式、系数各1分)
② 1 Cr2O72-+ 3 HSO3-+ 5H+ = 2 Cr3++ 3 SO42-+ 4 H2O(2分。写出H+1分,系数全部正确1分)
③Cr3++ 3OH-=Cr(OH)3↓(2分,化学式、系数各1分) 取沉淀后的上层清液测定其pH(1分),若pH≥8,则沉淀完全(1分)
(2)(8分)①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O(3分,化学式2分,系数1分) ②水中的H+在阴极区放电(1分),H+浓度减小促使水的电离平衡向右移动(1分),OH-浓度增大与金属阳离子在阴极区结合而沉淀完全(1分) ③0.08(2分。说明:含铬和铁两种氢氧化物沉淀)
解析试题分析: (1)①明矾是含有12个结晶水的KAl(SO4)2,该物质可做净水剂,此处加入该物质主要是利用其中的铝离子水解使溶液呈酸性,同时生成的氢氧化铝吸附杂质沉淀起到沉降杂质净化溶液的目的,所以此处考查的是铝离子的水解反应方程式,Al3++3H2O Al(OH)3+3H+ 。
Al(OH)3+3H+ 。
②此氧化还原反应中Cr2O72- 中铬的化合价+6→+3,HSO3- 中的S的化合价+4→+6,所以根据电子守恒配平发生化合价变化的的物质的,然后根据方程式前面少O的原则,前面所缺项应为H+,所以再根据电荷守恒配平方程式得1 Cr2O72-+ 3 HSO3-+ 5H+ = 2 Cr3++ 3 SO42-+ 4 H2O。
③题中流程可以看出,向沉淀池中加入氢氧化钠是为了沉淀得到Cr(OH)3 ,因此题干中所谓的沉淀法和中和法,主要是加入氢氧化钠能够首先中和溶液中的H+,其次能与溶液中的Cr3+结合生成Cr(OH)3 沉淀,因此此处发生的反应离子方程式除了H++OH-=H2O外,还有Cr3++ 3OH-=Cr(OH)3↓。若要证明Cr3+沉淀完全,则可以根据表中给的数据,Cr3+沉淀完全时的pH值等于8.0,若Cr3+沉淀完全,则用pH计可以测得溶液的pH值为8.0。
(2)①Fe2+ 具有还原性,酸性溶液中的Cr2O72- 强氧化性,二者容易发生氧化还原反应,因为此处是在处理酸性溶液中的Cr2O72- ,因此此出也是利用上题的沉淀法把Cr2O72-还原+3,价,然后沉淀除去,所以此反应的方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
②该电解反应的阳极铁电极主要发生氧化反应溶解产生亚铁离子还原Cr2O72- ,而阴极则主要是溶液中水电离的H+得到电子被还原,所以由于溶液中水电离的H+反应了,H+浓度减小水的电离平衡右移,OH-浓度增大,与金属阳离子Cr3+、Fe3+结合生成沉淀。
③根据①中反应的离子方程式可知,生成的金属阳离子比例关系是2Cr3+~6Fe3+ ,因此若含有0.01mol Cr2O72-,则会生成Cr3+ 0.02mol,Fe3+ 有0.06mol,因此总共会生成0.08mol的沉淀。
考点:本题考查的是简单的化学工艺流程。


科目:高中化学 来源: 题型:填空题
下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,利用2Na2S2+NaBr3 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
(1)当蓄电池工作放电时,电池中Na+的移动方向是:____ (填“电极a→b”或“电极b→a”),电极a的电极名称为 ,发生的电极反应为 。
(2)当蓄电池处于充电状态时,电极a应接外电源 极(填“正”或“负”),电极b的电极名称为 ,发生的电极反应为 。
(3)若左侧储罐的中溶液体积为VL(导管、泵及电池内部溶液忽略不计),一段时间观察,溶液中Na+的平均浓度由c1mol·L-1降至c2mol·L-1,则此装置该段时间正处于 (填“放电”或“充电”)状态,此过程中电极b上转移电子的物质的量共有__ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
金属的腐蚀是指____________________________________。
由于与金属接触的介质不同,发生腐蚀的化学原理也不同,一般可分为________________________和________________________,其中________________________更为普遍。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
从化工厂铬渣中提取硫酸钠的工艺如下: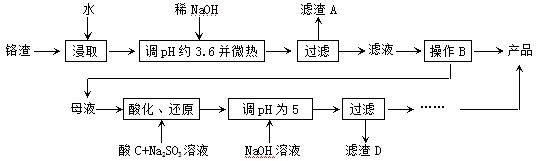
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤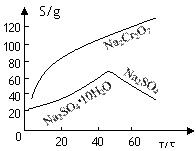
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)操作A的名称为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式 。
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_______方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
(1)该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO4溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。
实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的 极相连,阴极上的电极反应式为 。
实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学参考下表的数据,设计了如下方案:
试剂a是 (填化学式),其目的是 ;该方案能够除去的杂质离子是 (填离子符号)。
实验三 电解后溶液离子含量的测定
乙同学设计了如下方案: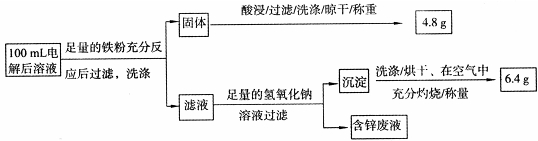
则100mL溶液中Cu2+的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为 ( )
| A.M + 3N mol | B.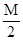 + 3N mol + 3N mol | C.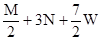 mol mol | D.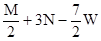 mol mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示 。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
| A.与CH3OH加成生成CH3CH2COOH | B.与H2O加成生成CH3COOH |
C.与CH3COOH加成生成CH3― ―O― ―O― ―CH3 ―CH3 | D.与HCl加成生成CH3COCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验不能获得成功的是 ( )
| | 实验目的 | 实验步骤 |
| A. | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B. | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C. | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D. | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com